高一化学第一学期期中测验
班别__________姓名__________学号__________成绩__________
可能用到的相对原子质量:Na—23 H—1 C---12 O---16
第Ⅰ卷(共72分)
一.选择题(本题共40分) ,每小题4分,只有一个正确选项。
1.下列各类反应一定是氧化还原反应的是…………………………( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
2.下列物质中属于电解质的是………………………………………( )
①氢氧化钠②硫酸钡③铜④蔗糖⑤二氧化硫
A. ①② B. ①②⑤ C. ③④ D. ①⑤
3.N aCl在熔融状态下能导电,其本质原因是………………………( )
A.是电解质 B.存在能够自由移动的离子
C.存在电子 D.存在离子
4.下列物质不能做氧化剂的是………………………………………( )
A.KNO3 B.KClO3 C.Cu D.SO2
5.下列变化需要加入氧化剂才能实现的是…………………………( )
A.S2- →HS- B.HCO3-→CO2- C.I-→I2- D.Cu2+→Cu
6.下列说法正确的是…………………………………………………( )
A.Na在自然界中主要以Na2CO3的形式存在
B.实验室存放钠时应放在煤油中使它跟空气和水隔绝
C.钠和钾的合金在室温下呈固态,是原子反应堆的导热剂
D.因高压钠灯发出的红光射程远透雾能力强故可做航标灯
7.金属钠放在水中浮在水面上,放在煤油中沉在煤油层下,煤油的密度是0.8g/cm3,推测钠的密度………………………………………………( )
A.大于1.0 g/cm3 B.小于0.8g/cm3
C.介于0.8 g/cm3~1.0 g/cm3之间 D.等于0.97 g/cm3
8.下列关于Na2O和Na2O2的叙述中错误的是……………………( )
A.是强氧化剂 B.呼吸面具中作为氧气的来源
C.可漂白织物 D.加热分解可制金属钠
9.下列哪个反应表示二氧化硫被还原………………………………( )
A.SO2+Cl2+2H2O=H2SO4+2HCl B.SO2+2H2S=2H2O+3S
C.SO2+2NaOH=Na2SO3+H2O D.SO2+PbO2=PbSO4
10.离子方程式CO32-+2H+=CO2↑+H2O表示…………………( )
A.碳酸盐与盐酸的之间的反应 B.可溶性碳酸盐与强酸之间的反应
C.一切碳酸盐与一切酸之间的反应 D.可溶性碳酸盐与一切酸之间的反应
二.选择题(本题共32分),每小题4分,每小题有一个或两个正确选项。只有一个选项的多选不给分;有两个正确选项的,选对一个给两分,选错该小题不给分。
11.下列反应属于氧化还原反应的是…………………………………( )
A. 2NaHCO3=Na2CO3+CO2↑+H2O B.2KMnO4=K2MnO4+MnO2+O2↑
C.Ca(OH)2+CO2=CaCO3↓+H2O D.Cu(OH)2+H2SO4=CuSO4+2H2O
12.加入NaOH溶液后,下列溶液中哪种离子数目会减少…………( )
A.CO32- B.Fe3+ C.SO42- D.H+
13.已知某溶液中含有大量的H+和Ba2+,则还有可能在该溶液中大量存在的离子是………………………………………………………………( )
A. SO42- B. CO32- C.Cu2+ D.Cl-
14.某溶液含Cl-、SO42-和S2-,要使每加入一种试剂(Ag+、Ba2+、Cu2+)只去掉一种离子,操作顺序是…………………………………………( )
A. Ba2+→Ag+→Cu2+ B. Cu2+→Ba2+→Ag+
C. Ag+→Ba2+→Cu2+ D. Cu2+→Ag+→Ba2+
15.下列离子方程式中正确的是………………………………………( )
A.石灰石与盐酸反应:CO32-+2H+=CO2↑+H2O
B.氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4
C.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D.碳酸钠与石灰水反应:Ca2++CO32-=CaCO3↓
16.用一定方法可除去下列物质中所含的少量杂质(括号内为杂质),其中加适量的盐酸能达到除杂质目的的是…………………………………( )
A.NaHCO3(Na2CO3) B.NaCl(NaOH)
C.Na2SO4(Na2CO3) D.Na2CO3(NaOH)
17.某物质灼烧时,焰色反应呈黄色,下列判断正确的是……………( )
A.该物质一定含钠元素 B.该物质一定是钠的化合物
C.该物质一定是钠 D. 不能确定是否含有钾元素
18.近代化学上常用CaH2(其中的H为负一价)作为生氢剂,其反应式为CaH2+2H2O=Ca(OH)2+2H2↑其中水为…………………………………( )
A.溶剂 B.还原剂
C. 既不是氧化剂也不是还原剂 D.氧化剂
第Ⅱ卷(共78分)
班别: 姓名: 座号: 成绩:
第Ⅰ卷答题表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
三、本题共两小题(共25分)
19.(10分)将一小粒金属钠投入盛有硫酸铜溶液的烧杯中,钠熔化成一个闪亮
的小球,说明该反应是 反应。离子方程式为:
![]()
![]()
请标明该反应的电子转移情况(用双线桥法)。实验完毕时,常发现所生成的沉淀中混有少量的黑色物质,你估计该黑色固体是 ,理由是:
![]()
![]() 。
。
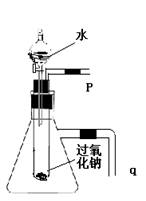
20.(15分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
|
![]()
过氧化钠跟水反应的化学方程式 ,
![]()
其中还原剂是 。
![]() (2)某研究性学习小组拟用如图1装置进行实验,
(2)某研究性学习小组拟用如图1装置进行实验,
以证明上述结论。
用以验证第一条结论的实验方法及现象是
![]() 用以验证第二条结论的实验方法及现象是
用以验证第二条结论的实验方法及现象是
![]()
![]()
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴加酚酞试液,发现溶液变红,振荡后,红色褪去。为探究此现象,该小组同学从查阅有关资料中得知:过氧化钠跟水反应可生成过氧化氢,过氧化氢具有强氧化性和漂白性。请设计一个简单的实验,证明过氧化钠和足量水充分反应后的溶液中有过氧化氢存在。现有硫化钠溶液、亚硫酸钠溶液、硫酸亚铁溶液、碘化钾溶液、红色布条等,请从中选择试剂,加以验证。(只要求列出实验所用的试剂及观察到的现象)。
试剂:
现象:
![]()
![]() 四、本题共三小题(共37分)
四、本题共三小题(共37分)
21.(6分)已知W2 + 2Y- ===2W- + Y2 Z2 + 2X- ===2Z- + X2
2Y- + X2 ===2X- + Y2 2W- + X2 ===2X- + W2
在W2、X2、Y2、Z2中,氧化性最强的是 ;
![]() 在W-、X-、Y-、Z-中,还原性最强的是
。
在W-、X-、Y-、Z-中,还原性最强的是
。
![]() 22.(15分)写出下列反应的离子方程式。
22.(15分)写出下列反应的离子方程式。
(1)稀硫酸与氢氧化钡溶液反应:
(2)氢氧化镁与盐酸反应:
(3)足量NaOH溶液与Ca(HCO3)2溶液反应
(4)过量CO2与KOH溶液反应
(5)苛性钠加入小苏打溶液中正好完全反应:
23.(16分)
(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
① O3:
② Na2O2:
![]() ③ Na2O:
③ Na2O:
(2)指出氧在下列各物质中的化合价:
O3 ; Na2O2 ; Na2O 。
![]()
![]() (3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式
![]()
![]() (4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:
(4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:
![]()
五、本题共一小题(共18分)
24.有16.8gNaHCO3粉末,经过加热一段时间,恢复到原来温度,称得质量为13.7g,求:
(1)NaHCO3的分解率。
(2)产生的CO2可跟多少gNa2O2恰好完全反应?
03---04学年第一学期期中测验高一化学试题答案
第Ⅰ卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | A | B | C | C | B | C | D | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | BD | CD | D | D | B | AD | D |
第Ⅱ卷
19.放热 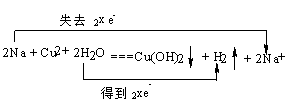 氧化铜
氧化铜
氢氧化铜受热分解生成氧化铜
20.(1)该反应为放热反应 2Na2O2 +2 H2O2 ===4NaOH + O2↑ Na2O2
(2)将带火星的木条靠近导管口p处,木条复燃。 将导管q浸入水中,过程反应中导管口有气泡冒出。
(3)(本小题有多组答案)
试剂:硫化钠溶液 红色布条
现象:溶液变浑浊 布条褪色
21.Z2 Y-
22.(1) 2H+ + SO42- + Ba2+ + 2OH- ===Ba(OH)2↓ + 2H2O
(2) Mg(OH)2 + 2H+ === Mg2+ + 2H2O
(3) 2OH- + Ca2+ + 2HCO3- === CaCO3 + CO32- + 2H2O
(4) OH- + CO2 === HCO3-
(5) OH- + HCO3- === CO32- + H2O
![]()
![]() 23 (1)① 3O2
2O3 ②
2Na + O2
Na2O2
23 (1)① 3O2
2O3 ②
2Na + O2
Na2O2
![]() ③4Na + O2 2Na2O
③4Na + O2 2Na2O
(2)0 , -1, -2.
(3)4KO2 + 2CO2 === 2K2CO3 + 3O2
(4)2 2 1 1 2 OH-
24. (1)50% (2) 3.9g