高一化学检测题
说明:
1、本试卷分I卷和Ⅱ卷,第I卷为客观题(选择题),答题时用2B或3B铅笔将答案填在机读答题卡上;第II卷为主观题,用蓝色或黑墨水钢笔直接答在试卷上。
2、答卷前务必将机读答题卡和第II卷上的考号、姓名等正确地填写清楚。
3、试题可能用到的原子量:
H-1 Na-23 Mg-24 Al-27 Fe-56 K-39 Cu-64 Ag-108 C-12 O-16 S-32 Cl-35.5 Br-80
第I卷(选择题,共45分)
一、选择题(本题包括15小题,每小题2分,共30分,每小题只有一个正确答案)
1、 在科学史上中国有许多重大的发明和发现,为世界现代物质文明奠定了基础。以下发明或发现属于化学史上中国对世界重大贡献的是( )
(1)造纸 (2)印刷技术 (3)火药 (4)指南针
(5)炼铜、炼铁、炼钢 (6)合成有机高分子材料
(7)人工合成牛胰岛素 (8)提出原子——分子论学说
A、(1)(2)(3)(4)(8) B、 (1)(3)(5)(7)
C、(2)(4)(6) D、(5)(6)(7)(8)
2、在下列各用途中,利用了物质的氧化性的是( )
A、用食盐腌渍食物 B、用盐酸除去铁钉表面的铁锈
C、用汽油擦洗衣料上的油 D、用漂粉精消毒游泳池中的水
3、下列燃料中,不属于化石燃料的是( )
A、煤 B、石油 C、天然气 D、水煤气
4、下列钠元素的化合物,无天然存在的是( )
j氧化物 k氢氧化物 l碳酸盐 m硝酸盐 …硫酸盐
A、jk B、除m外 C、kl D、不属于上述组合
5、同温同压下,两种气体的体积如果不相同,其主要原因是( )
A、气体的分子大小不同 B、气体分子间的平均距离不同
C、气体的性质不同 D、气体的物质的量不同
6、下列氢氧化物碱性最强的是( )
A、KOH B、LiOH C、NaOH D、CsOH
7、见光能分解的盐是( )
A、HClO B、AgBr C、氯水 D、Ca(ClO)2
8、在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A、Na+ K+ OH- Cl- B、Na+ Cu2+ SO42- NO3-
C、Mg2+ Na+ SO42- Cl- D、Ba2+ HCO3- NO3- K+
9、下列各溶液中,Na+物质的量浓度最大的是( )
A、4L0.5mol/LNaCl溶液 B、1L0.3mol/LNa2SO4溶液
C、5L0.4mol/LNaOH溶液 D、2L0.15mol/LNa3PO4
10、在下列各实验操作中,所使用仪器能达到目的的是( )
A、用50mL量筒准确量取45.25mL的浓硫酸
B、用托盘天平准确称取5.85g食盐
C、从碱式滴定管中准确放出15.00mL25%的氢氧化钠溶液
D、要配制250mL一定浓度的硫酸,可将适量浓硫酸引流到盛有水的250mL的容量瓶中然后加水至环形标线处
11、在氯水中加入KI溶液,振荡,再加入CCl4振荡后静置,观察到的现象是( )
A、液体呈紫红色B、液体分两层,上层紫红色,下层无色 C、液体分两层,上下均为紫红色 D、液体分两层,上层无色,下层紫色
12、下列离子方程式中,书写不正确的是( )
A、氯化钠溶液中加入硝酸银溶液:Ag+ + Cl- = AgCl↓
B、把金属钠放入水中:Na + 2H2O = Na+
+2OH- + H2↑
C、将溴水加入碘化钾溶液中:Br2
+ 2I- = 2Br- + I2
D、硝酸滴在石灰石上:CaCO3 +2H+ = Ca2+
+ CO2↑+ H2O
13、在3Cu+8HNO3(稀)![]() 3Cu(NO3)2+2NO↑+4H2O中,当有1.5molCu被氧化时,下列说法正确的是( )
3Cu(NO3)2+2NO↑+4H2O中,当有1.5molCu被氧化时,下列说法正确的是( )
A、有4molHNO3被还原 B、有1molHNO3被还原
C、有6mol电子发生转移 D、有12mol电子发生转移
14、强电解质和弱电解质的本质区别在于( )
A、强电解质易溶于水,弱电解质难溶于水
B、在溶液中的导电能力的强弱
C、在水溶液里电解质是否全部电离为离子
D、是离子化合物还是共价化合物
15、已知X2、Y2、Z2、W2四种物质的氧化性由强到弱顺序为W2>Z2>X2>Y2,下列氧化还原反应能发生的是:( )
A、2W-+Z2=2Z-+W2 B、2X-+Z2=2Z-+X2
C、2W-+Y2 = 2Y-+W2 D、2Z-+X2=2X-+Z2
二、选择题(本题包括5小题,每小题3分,共15分,每小题只有一个正确答案)
16、标准状况下,将aL氯化氢气体溶于1000g水中,得到盐酸密度为![]() ,则该盐酸的物质的量浓度是( )
,则该盐酸的物质的量浓度是( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
17、某氧化剂中,起到氧化作用的是X2O72-离子,在溶液中,2mol该离子
恰好能使6molSO32-离子完全氧化SO42-,则X2O72-离子在被还原后,X元素的化合价为( )
A、0 B、+2 C、+3 D、+4
18、过氧化钠和过量碳酸氢钠的固体混合物在密闭容器中充分加热后,容器中残留的固体物质是( ) 5、A
A、Na2CO3 B、NaHCO3和NaOH
C、Na2CO3和NaHCO3 D、Na2CO3和NaOH
19、配制1mol/L NaCl溶液250mL,在下列仪器中要用到的是( )
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯
⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A、①③⑤⑥⑨ B、②③④⑤⑥⑧
C、①③⑤⑥⑦ D、②③⑤⑥⑧⑨
20、工业上常用氨碱法制取碳酸钠(将NH3和CO2先后通入饱和食盐水
析出小苏打:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3+NH4Cl然后经过滤、焙烧而得到纯碱),但却不能用氨碱法制碳酸钾,这是因为在溶液中:
A、KHCO3的溶解度较大 B、KHCO3的溶解度较小
C、K2CO3的溶解度较大 D、K2CO3的溶解度较小
| 题号 | 三 | 四 | 五 | Ⅱ卷总分 | 总分人 |
| 得分 |
|
|
|
|
|
第Ⅱ卷(非选择题 共55分)
三、填空题(本题包括3个小题,共24分)
21、(12分)(1)、按氯元素的化合价由低到高的次序,写出四种常见的含氯元素化合物的化学式 、 、 、 ;
(2)、写出其中两种分别与![]() 混合加热时反应的化学方程式,然后任选一个方程式用双线桥标出电子转移的方向和数目(注意:只能选一个):
混合加热时反应的化学方程式,然后任选一个方程式用双线桥标出电子转移的方向和数目(注意:只能选一个):
① ;
② 。
(3)、MnO2在反应①中起 作用,在反应②中起 作用。
22、(4分)将下列离子方程式改写成可能的化学反应方程式:
(1)、CO32-+2H+=CO2↑+H2O
_______________________________________________________________
(2)、Ba2++SO4-+OH-+H+=BaSO4↓+H2O
_______________________________________________________________
23、(8分)已知有下面两个反应:
①CL2+2NaOH=NaCL+NaCLO+H2O ②NaCLO+HCl=NaCL+CL2↑+H2O
回答下列问题:
(1)、CLO-在反应①中是 在反应②中是 (填“氧化剂”、”还原剂”、”氧化产物”、”还原产物”);这两个反应
(填“是”、“不是”)可逆反应;
(2)、上述反应事实说明CLO-氧化性的强弱要受 的影响。
四、实验题(本题包括2个小题,共20分)
24、(8分)用滴管将新制的饱和氯水慢慢地滴入含酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪色。试回答下列问题:
(1)、实验室里氯水应保存在 (填“无色”或“棕色”) (填“广口”或“细口”)玻璃瓶中;
(2)、产生上述现象的原因有两种可能:
①是由于
②是由于
(3)、请你设计一个实验证明上述红色褪去的原因是①或者是②:
。
25、(12分)NaCL样品中混有少量的CaCL2、NaBr,按下列程序操作可得纯净的NaCL。
 |
(1)、X气体是 ,Y溶液是 ,Z溶液是 ;
(2)、操作(2)的名称是 ;
(3)、加入Y溶液的目的是 ;
过量的Z为什么不会存在于最后的白色固体中
。
五、计算题(本题包括2小题,共11分)
26、(6分) 用质量分数为98%、密度为1.84g/cm3的浓硫酸配制100mL1mol/L的稀硫酸溶液。(计算结果保留一位小数)
(1)、计算应取多少毫升的浓硫酸来配制;
(2)、计算浓硫酸的物质的量浓度;
(3)、已知1mol/L的稀硫酸的密度为1.06g/cm3,计算所需要的水的体积。
27、(5分)将Na2CO3和NaHCO3的固体混合物37.8克加热灼烧至质量不再改变为止,冷却,将所得固体加入足量的稀盐酸中,收集到标准状况下的气体6.72升。求原Na2CO3和NaHCO3的物质的量。
参考答案及评分标准
一、每小题2分,共30分
1、B 2、D 3、D 4、A 5、D 6、D 7、B 8、C 9、B 10、 C
11、D 12、B 13、B 14、C 15、B
二、每小题3分,共15分
16、B 17、C 18、A 19、A 20、A
三、填空题
21、(1)(每空1分)HCl、HCLO、KClO3、HCLO4(其他合理答案参照给分)
(2)(6分。方程式每写正确一个给2分,电子转移表示正确给2分)
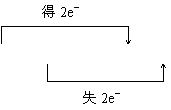 | |||
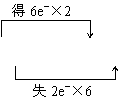 | |||
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O ②2KClO3
MnCl2+Cl2↑+2H2O ②2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(若两方程式的电子转移均正确得2分,但只要有一个错即得0分)
(3)(每空1分)①中起氧化剂的作用,②中起催化剂的作用
22、(每空2分,其他合理答案参照给分)
(1)、Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)、Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH
23、(每空2分)(1)氧化产物、氧化剂、不是 (2)、溶液酸碱性
四、实验题
24、((1)小题每空1分,(2)、(3)小题每空2分)
(1)棕色 细口 (2)①是:氯水把氢氧化钠消耗完,溶液中已无氢氧化钠
②是:氯水中的HClO将酚酞氧化而褪色
(3)将NaOH溶液滴入上述已褪色的溶液中:若溶液变红,证明褪色原因是①;若溶液不变红,证明褪色原因是②。
25、(每空2分)(1)、X : Cl2 Y: Na2CO3 Z: HCl
(2)过滤 (3)除去溶液中的Ca2+; 操作(3)进行蒸干时HCl已挥发
五、计算题
26、(每小题2分,其他解法参照给分)
(1)设应取Vml浓硫酸
1.84×V×98%=1×0.1×98 (1分)
v=5.4(ml) (1分)
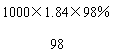 |
![]() (2)CH2SO4(浓)=
(2)CH2SO4(浓)=
=18.4(mol/l)(1分)
(3)设需水的体积为xml
x×1+1.84×5.4=1.06×100 (1分)
x=96.2(ml) (1分)
27、解:设原混合物中Na2CO3、NaHCO3的物质的量分别为X、Y
![]() 依题意可得:106x+84y=37.8 (2分)
依题意可得:106x+84y=37.8 (2分)
x+y/2=6.72/22.4 (2分)
解得:x=0.2mol y=0.2mol (1分)
(其他解法参照给分)