高一化学期末模拟试题
本试卷分第I卷(选择题)和第II卷(非选择题),共100分.考试时间90分钟.答题时,请将第I卷各题答案填在第5页的选择题答题的相应表格中,将第II卷各题答案直接答在试卷上.
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 Cu 64 Ba 137
第I卷(选择题 共55分)
一、选择题(本题包括5小题,每题2分,共10分。每小题只有一个正确选项。)
1.关于氯原子和氯离子的叙停正确的是
A.化学性质相同 B.原子核外电子总数相等
C.元素种类相同 D. 氯原子有颜色,氯离子没有颜色
2.下列元素在自然界中既能以游离态存在,又能以化合态存在的是
A.硫 B.氯 C.氟 D. 钾
3.食盐加碘是克服人体缺碘的主要措施,考虑碘元素的保存效果,在食盐中所加的微量碘应为
A.I2 B.KI C.NaI D. NaIO3或KIO3
4.为了除去氯化氢气体中的水蒸气,应使气体通过下列试剂中的
A.NaOH固体 B.浓硫酸 C.Na2CO3溶液 D.新制的生石灰
5.常温常压下,下列物质中属于有毒有色的气体是
A.CO B.SO2 C.Cl2 D. Br2
二、选择题(本题包括15个小题,每题2分,共30分。每小题有一个或两个正确选项。)
6.下列关于“摩尔”的叙述中正确的是
A.“摩尔”是物质的质量单位
B.“摩尔”是物质的数量单位
C.“摩尔”是既表示物质的质量单位,又表示物质的数量单位
D. “摩尔”是以阿伏加德罗常数为记数单位的物质的量的单位
7.下列反应的产物一定不正确的是
A.S+Cu → CuS
B. Cl2 + KOH → KCl + KClO + H2O
C. Fe+HCl → FeCl3+H2↑
D. P+Cl2 → PCl3
8.在通常状况下,气体的体积不取决于
A.气体分子的数目 B.气体的压强
C.气体的温度 D. 气体分子自身大小
9.用MnO2和浓盐酸反应制取氯气时,当有4mol HCl被氧化时,下列说法正确的是
A.反应中消耗了8mol HCl
B.生成了标准状况下的气体44.8L
C.生成了标准状况下的气体89.6L
D. 氯化氢是氧化剂
10.相同温度下,在一体积固定的密闭容器中分别装入下列气体,若气体密度相同,则容器内压强最大的是
A.O2 B.Cl2 C.H2 D. N2
11.在标准状况下,7g某气体A与8g O2所含的分子数相同,则该气体的密度为
A.1.25g·L-1 B.0.63g·L-1 C.2.5g·L-1 D. 1.43g·L-1
12.1g氢气完全燃烧生成液态水,放出14.2 kJ热量,下列热化学方程式书写正确的是
A.2H2(气)+ O2(气)=== 2H2O(液)+ 142.9 kJ
B.2H2(气)+ O2(气)=== 2H2O(液)+ 571.6 kJ
C.H2(气)+ 1/2O2(气)=== H2O(液)+285.8 kJ
D.2H2+ O2 === 2H2O(液)+571.6 kJ
13.实验室中的下列废液不能倒在同一废液缸中的是
A.K2SO3和浓盐酸 B.Na2SO4和BaCl2溶液
C.NaHSO4和Na2S溶液 D. Na2CO3和稀硫酸
14.锌钡白是一种白色颜料,其主要成分是难溶于水的锌和钡盐,它们是
A.ZnCO3和BaCl2 B.ZnCl2和BaCO3
C.ZnS和BaSO4 D.ZnCO3和Ba(NO3)2
15.在Cu + HNO3 → Cu(NO3)2 + NO2 + H2O的反应中,属于氧化剂的是
A.Cu B.HNO3 C.Cu(NO3)2 D. NO2
16.“酸雨”使森林死亡,湖泊酸化,古迹毁坏……,“酸雨”对人类生存的危害越来越清楚地显现在我们的面前,造成“酸雨”的主要原因是
A.大量燃烧含硫燃料,冶炼含硫矿物等
B.土壤的沙化、植被的破坏
C.过度排放城市污水
D. 大量丢弃废塑料
17.下列反应属于氧化还原反应的是
A. CuO + NH3 → Cu + N2 + H2O
B. NaOH + Al + H2O → NaAlO2 + H2↑
C. SO3 + H2O → H2SO4
D. ICl + H2O → HCl + HIO
18.下列反应既表现浓硫酸的酸性,又表现其氧化性的是
A. C + H2SO4(浓)→ CO2 + SO2↑+ H2O
B. Cu+H2SO4(浓)→ CuSO4 + SO2↑+ H2O
C. FeO + H2SO4(浓)→ Fe2(SO4)3 + SO2↑+ H2O
 D. Na2CO3 + H2SO4(浓)→ Na2SO4 + CO2↑+
H2O
D. Na2CO3 + H2SO4(浓)→ Na2SO4 + CO2↑+
H2O
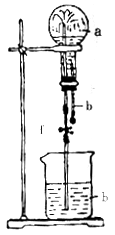
19.在右图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶 内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a、b不能形成喷泉的是
|
| a(干燥气体) | b(液体) |
| A. | SO2 | NaOH溶液 |
| B. | CO2 | NaOH溶液 |
| C. | HCl气体 | 水 |
| D. | H2S | 水 |
20.在5L硫酸铝溶液中含有Al3+离子的质量为27g,则此溶液中SO42-离子的物质的量浓度为
A.0.2 mol·L-1 B.0.3mol·L-1 C.1.5mol·L-1 D. 0.67mol·L-1
三、选择题(本题包括5个小题,每题3分,共15分。每小题只有一个正确选项)
21.若向一密闭容器中通入SO2和H2S气体共1 mol,充分反应后,容器内的压强是反应前容器内压强的1/4(不考虑气体在生成水中的溶解),则SO2和H2S的物质的量之比可能为
A.1:1 B.1:2 C.1:4 D. 4:1
22. mg Cu与足量的浓硫酸共热产生标准状况下的SO2n L,则下列叙述正确的是
A.被还原的硫酸的物质的量为n/22.4 mol
B.反应中转移的电子的物质的量为m/64 mol
C.反应中有2m mol硫酸参加了反应
D. 可生成64mg CuSO4
23.(CN)2的性质与卤素单质相似,在化学上称为“类卤素”,下列关于(CN)2的有关叙述不正确的是
A.把(CN)2通入NaOH溶液中可以生成NaCN和NaOCN
B.(CN)2可以做氧化剂
C.CN-离子在一定条件下可能被MnO2氧化
D. 把HCN通入AgNO3溶液中不可能产生沉淀
24.为了除去溴中的少量氯气,可以采用的方法是
A.向液溴中加入NaOH固体
B.向液溴中加入KBr固体粉末
C.向液溴中加入KBr溶液
D.向液溴中加入硝酸银溶液
25. 44.8 L H2S与33.6 L O2(标准状况下)混合后,点燃,充分反应后,下列有关叙述正确的是
A.可获得硫单质64g
B.反应中有4mol电子转移
C.氧化产物只有SO2
D.反应中有6 mol电子转移
第II卷(非选择题 共45分)
四、(本题包括2小题,共19分)
26.(12分)
(1)氧族元素包括________________(写出元素符号)
硫的原子结构示意图是________________________________
(2)H2O和H2Te的热稳定性:H2O_______________ H2Te(填<、>=)。
(3)Cl-和I-的还原性:Cl-________________________ I-(填<、>=)。
(4)若已知反应 H2S + Cl2 ==== 2HCl + S↓,则氯的非金属性_________________硫的非金属性(填<、>=)。
(5)若向淀粉KI溶液中通入少量氯气,反应现象是________________,发生反应的化学方程式为________________________.
(6)把SO2通入品红试液中,现象是______________,加热该溶液,现象是____________________,若向品红试液中通氯气,现象是___________________.
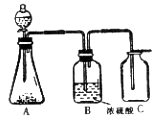 27.(7分)如右图所示,A是连有分液漏斗的气体发生装置,B中盛有浓硫酸,C是集气瓶。欲利用这套装置制取下列气体
27.(7分)如右图所示,A是连有分液漏斗的气体发生装置,B中盛有浓硫酸,C是集气瓶。欲利用这套装置制取下列气体
A.实验室制氯化氢 B.实验室制取硫化氢
C.实验室制取二氧化碳 D.实验室制取氢气
(1) 你认为合理的是________________________;
(2) 你认为不合理的是___________________,原因分别是__________________,___________________.
五、(本题包括2小题,共15分。)
28.(7分)某无色溶液可能含有下列钠盐中的几种:NaCl、Na2SO3、Na2SO4、Na2S和Na2CO3,向该溶液中加入适量稀硫酸后,有浅黄色沉淀生成,同时有有气味的气体逸出,将该气体依次通过CuSO4溶液、过量的澄清石灰水时,分别只得到黑色沉淀和白色沉淀。此溶液中至少存在钠盐是______,发生反应的化学方程式分别是:
(1) 产生浅黄色沉淀___________________________________
(2) 产生黑色沉淀_______________________________________
(3) 产生白色沉淀_________________________________________
29.(8分)阅读下面的文字,请把不恰当的地方改正过来。
某学生配制500 mL 0.2mol·L-1的NaOH溶液,他做了以下操作:①调整托盘天平,使指针指向标尺正中;②在托盘天平的托盘上放好两张质量相等的纸;③将砝码放在左盘,准确称量8 g NaOH固体并放在烧杯中,加入适量水使其完全溶解;④用玻璃棒引流,将溶液转移至容量瓶中;⑤继续向容量瓶中加入蒸馏水,使液面到达刻度;⑥盖好盖,将容量瓶放到指定位置。将实验台收拾整齐,擦干净。
(1)__________________________________________
(2)___________________________________________
(3)_____________________________________________
(4)_______________________________________________
(5)________________________________________________
(6)________________________________________________
六、(本题包括2小题,共11分。)
30.(4分)硫酸和盐酸组成的混合液100.0 mL,向里面加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。请分别求出原混合液中氯离子,硫酸根离子的物质的量的浓度。(设溶液总体积始终不变)
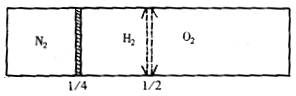 31.(7分)如图所示,密闭容器中有一个可以左右滑动的密封的隔板。在常温下,左侧装入N2,右侧装入H2和O2的混合气体,隔板正处于容器长度的1/4处静止不动,用电火花引燃H2和O2的混合气体,充分反应后,恢复至起始温度,隔板处于容器的正中间,静止不动。
31.(7分)如图所示,密闭容器中有一个可以左右滑动的密封的隔板。在常温下,左侧装入N2,右侧装入H2和O2的混合气体,隔板正处于容器长度的1/4处静止不动,用电火花引燃H2和O2的混合气体,充分反应后,恢复至起始温度,隔板处于容器的正中间,静止不动。
试计算反应前H2和O2的体积比。
高一化学期末模拟试题答案(第二卷)
26.(1) O S Se Te Po (2分,错1个扣1分,错2个即为0分)
![]() (1分)
(1分)
(2)> (1分)
(3)< (1分)
(4)> (1分)
(5)溶液由无色变为蓝色 (1分) 2KI + Cl2 = 2KCl + I2 (2分)
(6)红色褪去,变为无色溶液 (1分) 红色恢复 (1分) 溶液由红色变为无色(1分)
27.(1)A、C (各1分,共2分)
(2)B、D (各1分,共2分) B 浓H2SO4有强氧化性,H2S(气)还原性强,二者会发生氧化还原反应;
D H2密度比空气小,不能用向上排气法收集。(3分,错1个扣1分,全错不给分。)
28. Na2S、 Na2SO3、Na2CO3 (2分,Na2S与Na2SO3中少1个或2个扣1分,Na2CO3 1分。)
(1)Na2SO3 + 2Na2S + 3H2SO4 = 3Na2SO4 + 3S↓+ 3H2O
(或Na2SO3 + H2SO4 = H2SO3 + Na2SO4
Na2S + H2SO4 = H2S + Na2SO4
H2SO3 + 2H2S = 3S↓+ 3H2O) (3分,分步写分步给分)
(2)CuSO4 + H2S = CuS↓+ H2SO4 (1分)
(3)Ca(OH)2 + CO2 = CaCO3↓+H2O (1分)
29.(1)在天平左盘上放一小烧怀,右盘上放砝码。(1分)
(2)将NaOH固体溶解后放置至室温。(1分)
(3)将NaOH溶液转移至500 mL容量瓶中。 (1分)
(4)用蒸馏水洗涤烧杯、玻璃棒2-3次,并将洗涤液转移至容量瓶中。(2分)
(5)当液面距刻度2-3cm处时,改用胶头滴管加蒸镏水,至溶液凹面与刻度相切。 (2分)
(6)倒转摇匀,将溶液倒入指定试剂瓶中。(1分)
30.解:![]() (1分)
(1分)
溶液已呈碱性,Ba(OH)2过量
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
1 mol 1 mol
x 2.33/233 mol
解得x=0.0100 mol
剩余OH-的物质的量:0.100 mol·L-1×0.100 L = 0.0100 mol
n(HCl)=0.0250 mol 52-0.0100 mol - 0.0100 mol 52 = 0.0200 mol (1分)
因此,![]() (1分)
(1分)
![]() (1分)
(1分)
31.解:反应后隔板处于正中央,左右压强相等,则两边气体物质的量相等。(1分)依题意,设起始时左侧中N2为1 mol,则右侧中H2、O2共3 mol,反应后右侧剩余气体1mol,反应中消耗H2、O2共2mol(1分)
根据反应式 2H2 + O2![]() 2H2O
(1分)
2H2O
(1分)
反应消耗的H2为
![]() ×2
mol =
×2
mol = ![]() mol
mol
O2为![]() ×2mol
=
×2mol
= ![]() mol
(1分)
mol
(1分)
(1)若剩余气体为H2,则起始时H2的物质的量为:
n(H2)=![]() mol
+ 1mol=
mol
+ 1mol=![]() mol
mol
则原混合气中V(H2):V(O2)=7:2 (1分)
(2)若剩余气体为O2,则起始时O2的物质的量为:
n(O2)=![]() mol
+1mol =
mol
+1mol =![]() mol
mol
则原混合气中V(H2):V(O2)=4:5 (1分)
答:反应前H2和O2的体积比为7:2或4:5