高一化学上期期末考试
( 化学反应及其能量变化 碱金属 物质的量 卤素 )
_____班 学号:_____ 姓名:______________ 评分:________
相对原子质量: H 1 C 12 O 16 S 32 Cl 35.5 Cu 64
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有1个选项符合题意。)
1.由于“智力工程”的推行,“碘盐”已开始进入千家万户。 下列关于“碘盐”的叙述中,正确的是 ( )
A. “碘盐”宜密封保存 B. “碘盐”就是“I2+NaCl”
C. “碘盐”就是NaI D. 使用“碘盐”时宜高温煎炒
2.氯水可用来杀菌消毒又可作漂白剂,其中起作用的是 ( )
A. Cl2 B. HCl C. HClO D. O2
3.配制500 mL 0.1 mol / L硫酸铜溶液,需用胆矾 ( )
A. 8.00 g B. 16.0 g C. 25.0 g D. 12.5 g
4.不能使干燥的淀粉碘化钾试纸变蓝的是 ( )
A. 氯水 B. 溴水 C. 碘水 D. 盐酸
5.标准状况下,V L下列气体质量最大的是 ( )
A. H2 B. CH4 C. Cl2 D. CO2
6.a mol H2O和a mol CO2一定相同的是 ( )
A. 相同条件下的体积 B. 相同条件下的密度
C. 分子个数与原子个数 D. 质量
7.下列反应不能生成气体的是 ( )
A. 锌与稀盐酸反应 B. 过氧化钠与CO2反应
C. 二氧化锰与浓盐酸反应 D. 氧化钠与水反应
8.从100 mL 0.1 mol / L的AlCl3溶液中取出50 mL,其中Cl-的物质的量浓度是( )
A. 0.1 mol / L B. 0.05 mol / L C. 0.3 mol / L D. 0.15 mol / L
9.下列物质中,属于纯净物的是 ( )
A. 液氯 B. 氯水 C. 漂白粉 D. 盐酸
10.有关钠和钾的叙述中不正确的是 ( )
A. 钠、钾单质都是银白色的金属 B. 钠原子半径大于钾原子半径
C. 钠、钾的化合物都溶于水 D. 都可以用焰色反应鉴别
11.下列化合物中只能由两种单质直接化合而生成的是 ( )
A. FeCl2 B. NaCl C. Na2O2 D. NaOH
12.能与AgNO3溶液反应生成不溶于稀HNO3的黄色沉淀的卤素离子是 ( )
A. F- B. Cl- C. Br- D. I-
13.在盛有NaOH溶液的试剂瓶口,常看到白色固体生成,该固体是 ( )
A. NaOH B. Na2O C. Na2O2 D. Na2CO3
14.下列气体中在水中溶解度最大的是 ( )
A. Cl2 B. HCl C. CO2 D. O2
15.配制物质的量浓度溶液所必需要的专用仪器是 ( )
A. 容量瓶 B. 烧杯 C. 量筒 D. 滴定管
16.钾在焰色反应中的焰色为 ( )
A. 黄色 B. 紫色 C. 红色 D. 绿色
二、填空题(43分)
17.(16分)HCl是 色气体,纯溴是红棕色的 体,碘在加热时会发生 , Na燃烧的火焰焰色是 色,Na2O2是 色的粉末,它与CO2反应放出的气体是 ,具有漂白杀菌作用的物质是 。(任举一例)检验Cl-的方法是
。
18.(10分) (1)标出下列氧化还原反应中电子转移的方向和数目:
2K+2H2O=2KOH+H2
该反应的还原剂是______________,若反应有1 mol电子发生转移,则被还原的H2O是_____________ mol。
⑵ 写出硫酸铜溶液与硝酸钡溶液反应的离子方程式:
(3) 用化学方程式表示下面的离子方程式:
Ag++Cl- = AgCl¯
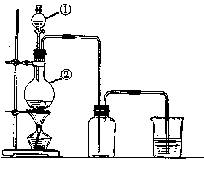 19.(10分) 右图为实验室制取氯气的装置图。
19.(10分) 右图为实验室制取氯气的装置图。
(1) 填写仪器名称:图中①、②分别是
。
(2) 写出实验室制取氯气的化学方程式:
。
(3) 在烧杯内装的是 ,它的作用是
。
20.(7分)无色气体A在一种黄绿色气体B中可安静地燃烧,发出苍白色火焰,反应生成气体C。把C溶于水所得的浓溶液(是一种酸)与MnO2加热反应可得到B。B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,F与CO2反应可得到气体G,D与水反应可生成A,A在G中燃烧生成水。由此推断:A_______,B________,C________,D_________,E_________,F________,G________。(写分子式或元素符号)
三、计算题(9分)
21.(9分)把过量锌中加入50 mL 6%的盐酸(密度为1.028 g / cm3)中。
(1) 该盐酸的物质的量浓度是多少?
(2) 与50 mL盐酸反应的锌的质量是多少克?
(3) 反应能生成多少毫升氢气?
附加题:(任选两题)
1.G、Q、X、Y、Z均为含氯的化合物,它们在一定条件下具有如下的转化关系:
① G ® Q+NaCl
② Q+H2O![]() X+H2+…
X+H2+…
③ Y+NaOH ® G+Q+H2O ④ Z+NaOH ® Q+X+H2O
由以上各反应判断:
(1) 这五种化合物中,氯元素的价态由低到高的顺序是 。
(2) 由反应②可看出Q、X中氯元素价态高低顺序所依据的理由是
。
2.今有H2和Cl2的混合气100 mL(标准状况下),其中一种气体体积为45 mL ,另一种气体体积为55 mL。光照两种气体发生反应后恢复到标准状况下,气体的体积变为______ mL。为证明反应后气体中有H2或Cl2剩余,使气体通过100 mL水,并使剩余气体干燥后,恢复到标准状况。
⑴ 若剩余气体为_______ mL,证明有____________剩余;
⑵ 若溶液有_________性,证明有_____________剩余;
答 案
1.A 2.C 3.D 4.D 5.C 6.C 7.D 8.C 9.A 10.B 11.C 12.D 13.D 14.B 15.A 16.B
17. (每空2分)无色;液;升华;黄;浅黄;O2;HClO;加入AgNO3,加入稀HNO3,生成的白色沉淀。
18. (1) (6分)
![]() 2e-
2e-
2K + 2H2O = 2KOH +H2; K; 0.5 mol ⑵(2分)Ba2++![]() = BaSO4¯ (3) (2分)AgNO3+KCl =KNO3+AgCl¯(任写一个正确的化学方程式皆可)
= BaSO4¯ (3) (2分)AgNO3+KCl =KNO3+AgCl¯(任写一个正确的化学方程式皆可)
19.
(每空2分) (1) 分液漏斗;烧瓶 (2) MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2 (3) 碱液,吸收多余的氯气,防止产生的氯气污染空气。
MnCl2+2H2O+Cl2 (3) 碱液,吸收多余的氯气,防止产生的氯气污染空气。
20. (每空1分)H2;Cl2;HCl;Na;NaCl;Na2O2;O2
21. (1) c(HCl)=![]() =1.69 mol / L
(4分)
=1.69 mol / L
(4分)
(2) Zn+2HCl=ZnCl2+H2 (1分)
n(HCl)=C(HCl)×V[HCl(aq)]=1.69 mol / L×0.05 L=0.0845 mol (2分)
[或n(HCl)=![]() =0.0845 mol ]
=0.0845 mol ]
反应的锌的物质的量为n(Zn)=![]() n(HCl)=0.0845 mol×
n(HCl)=0.0845 mol×![]() =0.04225 mol (1分)
=0.04225 mol (1分)
反应的锌的质量为m(Zn)=0.04225 mol×65 g / mol=2.74625 g (1分)
(3) n(H2)=![]() n(HCl)=0.0845 mol×
n(HCl)=0.0845 mol×![]() =0.04225 mol
(2分)
=0.04225 mol
(2分)
V(H2)=n(H2)×Vm=0.04225 mol×22.4 L / mol=0.9464 L=946.4 mL。 (2分)
附加题:
1. (每小题5分)(1) G<Y<Q<Z<X (2) 电解Q的水溶液时,X化合价必升高
2. (每空2分) 100 (1) 10; H2 (2) 氧化; Cl2