原子结构测试题
一、选择题
1、同种元素的原子一定具有
A.不同的质量数 B.相同中子数
C.相同的质子数 D.不同的电子数
2、下列关于原子的叙述正确的是
A.![]() 表示氢原子核的质子数是1,中子数也是1。
表示氢原子核的质子数是1,中子数也是1。
B.![]() 表示碳的一种同位素原子中含有7个质子和7个中子。
表示碳的一种同位素原子中含有7个质子和7个中子。
C.![]() 表示该微粒的质量数为19,电子数为9。
表示该微粒的质量数为19,电子数为9。
D.![]() 表示两种原子含有相同的中子数。
表示两种原子含有相同的中子数。
3、下列说法正确的是
A.原子核都是由质子和中子构成的
B.不同元素原子的质量数一定不等
C.质子数相同的不同微粒,化学性质可能相同
D.质子数相同的不同微粒具有相同的电子数
4、科学家最近制造出第112号新元素(核电荷数为112),其原子的质量数为277,这是迄今已知元素中最重的原子。关于该新元素的下列叙述正确的是
A.其原子核内中子数和质子数都是112
B.其原子核内中子数为165,核外电子数为112
C.其原子质量是![]() 原子质量的277倍
原子质量的277倍
D.其原子质量与![]() 原子质量之比277∶12
原子质量之比277∶12
5、有关等物质的量的![]() 原子和
原子和![]() 原子,下列叙述正确的是
原子,下列叙述正确的是
含有相同数目的原子 ‚含有相同物质的量的质子
ƒ属于同种元素 „具有相同的质量
…中子数相等 †电子数相等
‡完全燃烧时消耗氧气的质量相等 ˆ具有几乎相同的化学性质
A.只有‚ƒ… B.只有‚ƒ
C.全正确 D.除„…外都正确
6、若某阳离子X2+有m个电子,其质量数为a,则核内中子数为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
7、简单离子![]() 核外有x个电子,A的质量数可表示为
核外有x个电子,A的质量数可表示为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8、下列微粒中,电子数目最多的是:
A.H2O B.NH3 C.Na+ D.Al
9、下列离子的电子排布与氩原子核外电子排布不同的是:
A.Mg2+ B.S2- C.K+ D.Cl-
10、某元素原子核外电子排布为:L层电子数是K层和M层电子数之和的两倍,则某元素是:
A.钠 B.镁 C.氖 D.氯
11、比较多电子原子中电子能量大小的依据是:
A.原子核的电荷数 B.所处的电子层
C.电子离核远近不同 D.不能比较
12、下列微粒中与OH-离子具有不相同的质子数和相同的电子数,该微粒可能为:
A.F- B.Mg2+
C.NH2- D.CH4
13、X元素的原子其核电荷数为n,X2-离子和Y3+离子的电子层结构相同,则Y原子的质子数是:
A.n+1 B.n+2
C.n+3 D.n+5
14、含有4个原子核,10个电子的微粒是:
A.CH4 B.NH4+
C.H3O+ D.PH3
15、某化合物由A、B两元素组成,已知A、B两元素质量比为7∶4,原子量比为
7∶8,则化合物可能是:
A.A2B B.AB2
C.AB3 D.A2B5
16、某离子的原子核里有n个质子,该离子的电子层排布与氖原子相同,则它所带的电荷数 可能是:
A.n-10 B.10-n
C.n+10 D.![]()
17、有![]() 两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是:
两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是:
A.b-a=n+m B.a-b=n+m
C.离子半径 ![]() D.质子数Y>X
D.质子数Y>X
18、质量数为27的元素R,其核内有14个中子,则R可形成的离子是:
A.R+ B.R2+ C.R3+ D.R2-
19、某元素原子L层电子数比K层电子数多5个,该元素的最高正化合价为
A.+5 B.+6 C.+7 D.无最高正化合价
20、下列各组元素性质递变情况错误的是:
A.Li、B、Be原子最外层电子数依次增多
B.P、S、Cl最高正化合价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
21、元素化合价一般决定于原子的
A.核内质子数 B.核外电子数
C.核外电子层数 D.最外层电子数
22、M层有2个价电子的元素A和L层有5个价电子的元素B,组成稳定的化合物,该化合物的式量为
A.88 B.40 C.100 D.72
23、某元素的原子中含相同的质子数和中子数。R元素的气态氢化物中,R与H的原子个数比为1∶4,质量比为7∶1,则R的最高价氧化物的化学式为
A.CO2 B.SiO2 C.SO2 D.NO2
24、已知元素R的某种同位素的氯化物RClx为离子化合物,其中该元素的阳离子的核内有y个中子,核外有z个电子,则该同位素的组成可表示为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
25、核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的量为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
26、1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是![]() ,它的中子数为
,它的中子数为
A.80 B.128 C.208 D.288
27、下列分子或离子中,与氖原子含有相同电子数的是
①F- ②Na+ ③HF ④NH3 ⑤CH4
A.仅①②③ B.仅②③④ C.仅①②⑤ D.①②③④⑤
二、填空题
28、在1—18号元素中,电子总数是最外层电子数二倍的元素是 ;最外层电子数是次外层电子数二倍的是 ;次外层电子数是最外层电子数二倍的是 。
29、最外层(M层)电子数为6的原子,核电荷数为 ,原子结构简图为 ,气态氢化物的分子式为 ,向此氢化物的水溶液中滴加石蕊后呈 色。
30、下列各题中的物质均由核电荷数为1—10的元素组成,请填写化学式。
(1)只有两个原子核和两个电子组成的分子是 ;
(2)1个最外层有4个电子的原子,和2个最外层有6个电子的原子结合的分子是 ;
(3)1个最外层有5个电子的原子和3个只有1个电子的原子结合的分子是 ;
(4)由3个最外层是6个电子的原子结合而形成的分子是 ;
(5)由两个原子核10个电子结合而成的分子是 ,由五个原子核10个电子结合而成的分子是 ,
31、画出下列几种微粒的结构示意图,并写出微粒符号:
(1)原子核内有2个质子的原子 、 。
(2)核外有18个电子的二价阳离子 、 。
(3)核外有18个电子的一价阴离子 、 。
(4)原子核外L层为最外层,L层电子数是K层电子数3倍的原子 、 。
32、元素![]() 形成化合物时,其显最高正价为 ,显负价时为 ;元素
形成化合物时,其显最高正价为 ,显负价时为 ;元素![]() 在其化合物中,最高价为 ,负价为
。
在其化合物中,最高价为 ,负价为
。
33、某金属元素R原子的质量数为52,已知Rn+离子含有28个中子和21个电子,则R显+n价时的氢氧化物,其化学式为 。
34、某非金属元素X的最高价为+n,它的最高价氧化物对应的酸的化学式中含有b个氧原子和一个X原子,则这种酸的化学式为 。
原子结构测试题答案
一、1、C2、D 3、C 4、BD 5、D 6、C 7、A 8、D 9、A 10、B 11、B 12、B D 13、D 14、C 15、A 16、A B 17、B C 18、C 19、D 20、A C 21、D 22、C 23、B 24、D 25、A 26、B 27、D
二、
28、①铍![]() ②碳
②碳 ![]() ③
锂
③
锂![]() 、硅
、硅 ![]()
29、①16 ②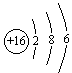 ③H2S ④红
③H2S ④红
30、(1)H2 (2)CO2 (3)NH3 (4)O3 (5)①HF ②CH4
31、
、
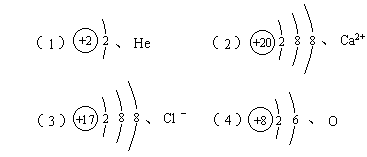
32、①+7 ②-1 ③0 ④-1
33、R(OH)3
34、![]()