高一第一学期化学期末测试卷
说明:本试卷分第I卷和第Ⅱ卷,共120分,答题时间100分钟
可能用到的相对原子质量:H―1 C-12 O-16 Na-23 Cl-35.5 K-39 Ca-40 Br-80
班级 姓名 成绩
第I卷(选择题 共60分)
一、(本题共15个小题,每小题4分,共60分。每小题只有一个选项符合题意)
1.方志敏烈士生前曾用米汤(内含淀粉)给鲁迅写信,鲁迅收到信后,为了看清信中的内容,使用的化学试剂是 ( )
A、碘化钾 B、碘酒 C、溴水 D、淀粉碘化钾溶液
2.下列科学家中,为我国化学工业做出重大贡献的是 ( )
A、邓稼先 B、李四光 C、华罗庚 D、候德榜
3.下列仪器中,“0”刻度在上端的是 ( )
A、量筒 B、滴定管 C、温度计 D、容量瓶
4.氧化钠与过氧化钠的共同之处是 ( )
A、均是淡黄色固体 B、均是碱性氧化物
C、均与水反应生成碱 D、均与二氧化碳反应放出氧气
5.下列说法中正确的是 ( )
A、干冰蒸发要吸收大量的热,这就是化学反应中的吸热现象
B、放热反应中的反应物处于能量较低的状态
C、木炭常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应
D、人们用氢氧焰焊接金属,主要是利用了氢气和氧气化合时所放出的能量
6.质量相等的两份样品,一份是CO,另一份是CO2,这两份气体样品中,CO与CO2所含氧原子的原子个数之比是 ( )
A、1 :2 B、1 :4 C、11 :14 D、11 :28
7.下列反应的离子方程式正确的是 ( )
A.碳酸钙溶于醋酸:CaCO3 + 2 H+ = Ca2+ + 2 H2O + CO2↑
B.澄清石灰水中加入盐酸:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C.氯气通入水中:Cl2 + H2O = 2H+ + Cl- + ClO-
D.小苏打溶液和硫酸混合:HCO3- + H+ = H2O + CO2↑
8.某溶液中含有大量的Ag+、Cu2+、Ba2+三种离子中的两种和NO3-、Cl-、OH-、CO32-、四种阴离子中的两种。该溶液中大量含有的四种离子应该是 ( )
A.Ag+、Cu2+、NO3-、Cl- B。Ag+、Ba2+ 、Cl-、OH-、
C.Cu2+、Ba2+ NO3-、Cl- D。Ag+、Cu2+、 NO3-、CO32-
9.某学生配制1mol/L的NaOH溶液100mL,结果实际浓度偏高,造成的原因是 ( )
A.天平称量结束时,指针指向标尺左边 B.洗涤液全部转移互容量瓶中
C.摇匀后,凹液面低于刻度线 D.定容时俯视刻度线
10.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1L0.2mol/L Ba(OH)2溶液中含有0.2NA个NO3-
B.标准状况下,22.4L氯气中所含的氯原子数为NA
C.16g O2中所含的氧原子数为NA
D.常温常压下1mol氦气所含有的核外电子数为4NA
11.反应8NH3 + 3Cl2 == 6NH4Cl + N2中,当有2mol NH3被氧化时,转移的电子总数是 ( )
A.6个 B.6NA C. 1.5NA D .8NA
12.将一定量的Na2CO3·10H2O与NaHCO3的混合物完全溶解于水,配成100mL溶液,测得溶液中Na+的浓度为0.4mol/L,若将溶液蒸干并灼烧到质量不变,可得到固体的质量是 ( )
A. 0.92g B. 1.68g C. 2.12g D. 2.55g
13.按F、Cl、Br、I的顺序,下列对卤素性质叙述错误的是 ( )
A.原子半径依次增大 B.卤化氢稳定性依次减弱
C.单质的氧化性依次增强 D.单质的熔沸点依次升高
14.对于反应H- +NH3 == H2 + NH2-,下列说法中正确的是 ( )
A.该反应属于置换反应 B.该反应中H-是氧化剂
C.该反应中NH3是还原剂 D.氧化产物和还原产生都是氢气
15.下列说法错误的是 ( )
A.用稀盐酸清洗做焰色反应的镍铬丝 B.用酒精萃取碘水中的碘
C.用25mL的碱式滴定管量取14.80mL的NaOH溶液
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 分数 | ||||||||
| 序号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 分数 |
第II卷(非选择题 共60分)
二、(本题包括2小题,共23分)
 16.(1)已知:4Fe3+ + 2H2O
16.(1)已知:4Fe3+ + 2H2O
![]() Fe2+ +
4H+ + O2↑每生成32gO2,电子转移的物质的量为
Fe2+ +
4H+ + O2↑每生成32gO2,电子转移的物质的量为
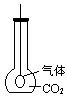
(2)如右图所示,用烧瓶收集CO2气体,在瓶内有一只扎紧在玻璃管末端的气球,打开塞子,迅速往瓶内加入Na2O2立即塞紧塞子,一段时间后,可观察到的现象为 。
(3)氯气是有毒的,曾被法西斯制成毒气用于侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是 A:人、畜躲在 的地方(填“低洼”或“较高”)。
B:可用 浸湿软布蒙面。(从①肥皂水 ②尿 ③石灰水 ④纯碱水 ⑤NaOH溶液,填序号)。
(4)有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ;还原性最强的是 ,用离子方程式来表示这两种粒子间所发生的反应 。
17.一种白色粉末A,是由NaCl K2SO4、 Na2CO3、 KHCO3、NaHCO3等五种物质中的两种组成。取少量A溶于水,进行焰色反应,火焰呈黄色,说明A中含有 ,若透过蓝色钴玻璃可观察到火焰呈紫色,说明A中含有 ,取少量A,加入稀盐酸后,有无色略带酸味的气体产生,此气体能使澄清石灰不变混浊,说明A中含有 (离子)或 (离子),取少量A的溶液,加入BaCl2溶液,观察不到明显变化,另取少量A的溶液,加入用稀HNO3酸化的AgNO3溶液,没有沉淀生成,说明A中一定不含有 ,因此A是由 和 组成。
 三、(本题包括2小题 共20分)
三、(本题包括2小题 共20分)
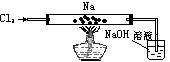
18.如下图装好实验仪器和药品,通Cl2,先排出装置中的空气,直至玻璃管中充满足够气体时,管内气体呈 色,加热金属钠,使其熔化并开始剧烈反应,看到钠燃烧的火焰呈黄色,并有 产生,反应完全后,停止加热冷却后,看到试管壁上有 色固体附着,尾气吸收的离子方程式为 ,实验室制取的化学方程式为 。
19.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g 。
②装好实验装置。
③检验装置气密性。
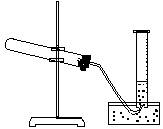 ④加热,开始反应,直至产生一定量的气体。
④加热,开始反应,直至产生一定量的气体。
⑤停止加热(如下图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g .
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1) 如何检查装置的气密性?
(2) 以下是测量收集到气体体积必须包括的几个步骤:
① 调整量筒内外液面高度使之相同;
② 使试管和量筒内的气体都冷却室温;
③ 读取量筒内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3) 测量收集到气体体积时,如何使量筒内外液面高度相同?
(4) 如果实验中得到的氧气体积是 c L(已折算成0℃、1.01×105Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含 a、b、c,不必化简)
M(O2)= 。
四、计算题(本题包括2小题 共17分)
20.(8分)将10.000g氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为9.813g。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为0.721g,求原混合物中各化合物质量。(精确到0.01g)
21.(9分)将250mLH2SO4的质量分数为15%、密度为1.1g/cm3的硫酸溶液跟过量的铁屑充分反应。计算:
(1) 此硫酸中H2SO4的物质的量浓度是多少?
(2) 制得氢气(标准状况)的体积为多少?
(3) 把生成的FeSO4配成400mL溶液,此溶液中FeSO4的物质的量浓度是多少?
答案:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | D | B | C | D | C | D | C |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| D | C | B | C | C | D | B |
16.(1)4mol (2) 气球膨胀 (3)A:较高,B:①②③④ (4)Br2 ; I- ; Br2 +2I-=I2 +2Br-
![]() 17.Na元素; K元素; CO32-,HCO3-; K2SO4,Na2CO3,NaCl; KHCO3
,NaHCO3 。
17.Na元素; K元素; CO32-,HCO3-; K2SO4,Na2CO3,NaCl; KHCO3
,NaHCO3 。
18.黄绿色,白烟,白色,Cl2 + 2OH- = Cl- + ClO- + H2O ;
19.(1)将装置连接好后,将导管插入水槽里,用手握住试管,若 导管口有气泡冒出,则装置气密性好
(2)②①③
(3) 量筒上下移动 ,直至内外液面高度一致。
(4)![]()
20.m(KBr)=0.50g m(CaCl2)=0.80 m(NaCl)=8.70g
21.(1)c (H2SO4)=1.70mol/L (2)V(H2)= 10.08L (3)c (FeSO4) =1.125mol/L