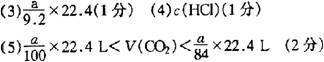高一第一学期期末统测化学试题
考试时间:100分钟 满分:100分
第Ⅰ卷(选择题共50分)
可能用到的相对原子质量:H—1 O—16 Na—23 Mn—55 Cl—35.5
一、选择题(共50分,每题仅有一个选项符合题意,其中1—10题每题3分,11—15题每题4分。)
1. 碘缺乏病是导致人类智力障碍的主要原因之一,为解决这一问题,你认为最经济可行的措施是 ( )
A.食盐加碘 B.饮用水加碘
C.大量食用海带 D.注射含碘药剂
2. 下列化学反应的实验现象描述错误的是 ( )
A.Na在Cl2中燃烧生成白烟
B.Cu在Cl2中燃烧生成棕黄色的烟
C.红磷在Cl2中燃烧生成白色烟雾
D.H2在Cl2中燃烧产生淡蓝色的火焰
3. 下列物质的性质的比较中错误的是 ( )
A.溶解性:Na2CO3<NaHCO3 B.热稳定性:HF>HCl>HBr>HI
C.熔点:Li>Na>K>Rb>Cs D.氧化性:F2>Cl2>Br2>I2
4. 下列关于物质的用途叙述不正确的是 ( )
A.K、Na合金用做原子反应堆的导热剂 B.Na2O2常用作漂白剂
C.Cl2 用于自来水的净水剂 D.AgI用于人工降雨
5. 将一小块金属钾投入下列物质的水溶液中,既能生成气体,又能生成沉淀的是 ( )
A.NH4Cl B.CuSO4 C.NaNO3 D.BaCl2
6. 设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.2.3g钠由原子变为离子时,失去的电子数为0.2NA
B.18g水所含的原子数为10NA
C.35.5g氯气所含的原子数为NA
D.常温常压下,11.2L氧气所含的原子数为NA
7. 下列贮存药品的方法,不正确的是 ( )
A.少量锂贮存在煤油中 B.氯水应保存在棕色细口试剂瓶中
C.漂白粉应隔绝空气密封保存 D.盛溴的试剂瓶里加一些水液封
8. 在无色透明的强酸性溶液中能大量共存的离子组是 ( )
A.Al3+ Ag+ NO3- Cl- B.Mg2+ NH4+ NO3- Cl-
C.Ba2+ K+ HO- Cl- D.Zn2+ Na+ MnO4- SO42-
9. 下列溶液中的c(Cl-)与50mL 1 mol/L的A1C13溶液中的c(Cl-)相等的是 ( )
A.150mL 1 mol/L的NaCl B.75 mL 3 mol/L的NH4Cl
C.75mL2mol/L的MgCl2 D.100mLI mol/L的FeCl2
10.下列物质中属于非电解质,但放入水中所得溶液导电性明显增强的是 ( )
A.三氧化硫 B.乙醇 C.金属钠 D.氯化钠
11.下列离子方程式书写正确的是 ( )
A.金属钠投入到水中: Na+2H2O = Na++2 HO-+H2↑
B.Cl2与H2O反应: Cl2+H2O=H++ Cl-+HClO
C.澄清Ca(OH)2溶液与过量CO2反应:Ca2++2 HO-+CO2 = CaCO3↓+H2O
D.实验室用浓盐酸和二氧化锰反应:MnO2+2H++2 Cl-=Mn2++Cl2↑+H2O
12.已知反应2X-+Z2 = 2Z-+X2,2W-+X2 = 2X-+W2,能从左向右进行,则反应W2+2Z-= Z2+2W-进行的方向是 ( )
A.从左向右 B.从右向左 C.不能进行 D.无法判断
13. 质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水。得到的溶液每毫升质量为q g,物质的量浓度为c。则溶质的相对分子质量为 ( )
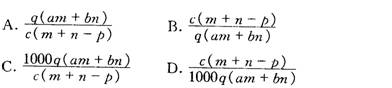
14.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-= RO4-+2F-+H2O从而可知在RO3n-中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
15.甲、乙、丙、丁四个烧杯中分别加入0.1mol Na、Na2O、Na2O2、NaOH,各加入100mL水,搅拌,使固体完全溶解,则四个烧杯的溶液中NaOH的质量分数大小顺序正确的是 ( )
A.丁>丙>乙>甲 B.丙=乙>甲>丁
C.丙=乙>丁=甲 D.丙>乙>甲>丁
第Ⅱ卷(非选择题共50分)
二、(本题包括2小题,共10分)
16.(6分)新制的氯水显 色,说明氯水中有 分子存在;蓝色石蕊试纸遇到新制氯水后,首先变 色,说明其中有 存在;但很快又 ,说明有 存在。
17.(4分)某研究性学习小组在做Na2O2与水反应实验时,在反应后的溶液中滴加酚酞试液,溶液呈红色,但很快褪去。甲、乙、丙三同学对此现象分别做了如下推测: 甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。乙:因为所加的水量较少,红色褪去可能是c(NaOH)较大使红色褪去。丙:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。 请以简单的方法给三位同学的推测以评判。
18.(6分)在某澄清溶液中,可能存在下述几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下述实验:(1)用pH试纸检验,该溶液呈强酸性;(2)取部分溶液,滴人几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;(3)另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。根据上述实验现象,推断原溶液中肯定存在的离子是 ,肯定不存在的离子是 ,可能存在的离子是 ,要检验可能存在的离子可采用 验方法。
19.(8分)已知A、B、C是由H、O、Na三种元素中的两种或三种组成的化合物;甲、乙、丙是三种分别由上述三种元素组成的单质,上述化合物和单质之间存在如下转化关系:
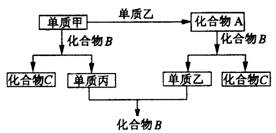
据此推断(写化学式)
①化合物A、B、C分别为 A ;B ;C 。
②单质甲、乙、丙分别为 甲 ;乙 ;丙 。
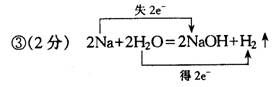
③写出甲+B=丙+C的化学方程式,并用双线桥表示其电子转移的方向和数目:
四、(本题包括2小题,共15分)
20.(6分)实验室用2.0mol/L NaCl溶液配制100mL0.5 mol/L NaCl溶液。
(1)配制上述溶液,需要2.0mol/L NaCl溶液 mL。
(2)配制上述溶液除需要100mL容量瓶、玻璃棒、烧杯、量筒外,还需要的仪器有 。
(3)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①没有洗涤烧杯和玻璃棒。 ;
②定容时俯视容量瓶的刻度线。 ;
③如果加水超过了刻度线,取出液体使液面恰好到刻度线。 。
21.(9分)已知:KMnO4和浓盐酸混合时,在常温下即可发生反应生成KCl、MnCl2、Cl2和H2O。某课外兴趣小组在实验室里用干燥而纯净的Cl2和Cu反应,通过下列装置制取少量纯净的CuCl2。除图中已经给出的药品外,还可提供的药品有:①KMnO4固体 ②MnO2固体 ③浓盐酸
(1)(A)装置烧瓶中应选用的试剂是
(2)将图中装置按气体流向从左至右连接成整套实验装置(填写各接口数字代号)
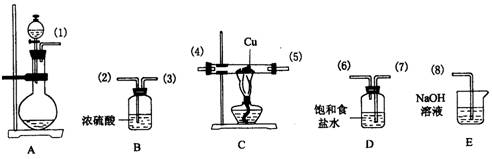
(3)(B)装置中浓H2SO4作用为
(4)(C)装置中发生反应的化学方程式为
(5)(D)装置中饱和食盐水作用为
(6)(E)装置中NaOH溶液作用为
离子方程式为
五、(本题包括2小题,共11分)
22.(5分)将标准状况下VLHCl气体溶解于水,形成50mL浓度为12mol/L的浓盐酸,已知所得浓盐酸的密度为1.2g/cm3,试计算:(1)V值;(2)浓盐酸中HCl的质量分数。
23.(6分)以等物质的量的NaHCO3、KHCO3的混合物a g与100mL盐酸反应。通过计算,分析回答下列问题(题中涉及的气体体积均以标准状况计,填写时可以含a的代数式表示)。
(1)碳酸氢盐混合物的平均摩尔质量为 g·mol-1。
(2)若碳酸氢盐与盐酸恰好完全反应,则c(HCl)= mol·L-1。
(3)若盐酸过量,生成的V(CO2)为 L。
(4)若碳酸氢盐过量,欲计算V(CO2),还需提供的物理量是 。
(5)若混合物中n(NaHCO3) ≠ n(KHCO3),则a g碳酸氢盐与足量盐酸完全反应生成的V(CO2)的范围是
第一学期高一期末统测
化学试题参考答案及评分标准
一、选择题(共50分,每题仅有一个选项符合题意,其中l一10题每题3分,11—15题每题4分)
1.A 2.D 3.A 4.C 5.B 6.C 7.A 8.B 9.B 10.A
11.B 12.B 13.C 4.B 5.B
二、(本题包括两小题,共10分)
16.(淡)黄绿色,Cl2;红,H+;褪色,HClO。(每空1分)
17.将“红色褪去”的溶液分别经冷却和加水稀释,红色都不复出现,则丙同学的推测正确。 (其它合理答案也得分) (4分)
三、(本题包括两小题,共14分)
18.H+、Ba2+、I—(2分);SO42-、CO32-(2分);K+(1分);焰色反应(1分)
19.①A、Na2O2 B、H2O C、NaOH(每空1分)
②甲 Na 乙 O2 丙 H2 (每空1分)
四、(本题包括两小题,共15分)
20.(1)25.0(2分); (2)胶头滴管(1分) (3)①偏低 ②偏高 ③偏低(每空1分)
21.(1)固体KMnO4(1分)
(2)①⑦⑥②③④⑤⑧或①⑦⑥②③⑤④⑧(2分)
(3)干燥氯气(1分)
(4)Cu+Cl2 ![]() CuCl2(1分)
CuCl2(1分)
(5)除氯气中的氯化氢(1分)
(6)吸收多余氯气,防止污染环境(1分)
Cl2+2OH-=H2O+ Cl-+ClO- (2分)
五、(本题包括两小题,共11分)
22.(1)13.44(2分) (2)36.5%(3分)
23.(1)92(1分) (2) ![]() (1分)
(1分)