高一化学八校联考测试题
(考试范围第1章—第4章,满分100分)
班级 姓名 成绩
说明:本试卷分第Ⅰ卷选择题和第Ⅱ卷非选择题两部分,共100分,考试时间100分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 S7—32 Cl—35.5 K—39 Fe—56 Zn—65 Mn—55 Br—80
第Ⅰ卷 (共60分)
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意。)
1.下列关于氯气的描述中,正确的是 ( )
A. 在常温常压下,氯气是一种有毒无剌激性气味的黄绿色气体
B. 氯气比氧气容易液化,比氧气易溶于水
C. 液氯与氯水均为纯净物
D. 氯气是一种比空气轻的气体
2.金属钠在化学反应中变成氢氧化钠,这一过程一定是 ( )
A. 化合反应 B. 氧化反应 C. 复分解反应 D. 分解反应
3.阿伏加德罗常数是 ( )
A. 6.02×1023 B. 比较精确的实验值
C. 12 g碳含有的原子数 D. 0.012 kg碳—12含有的碳原子数
4.NaOH浓溶液不慎洒到皮肤上,正确的处理方法是 ( )
A. 先涂硼酸后,再用水冲洗
B. 先用抹布抹去,再用水冲洗,最后涂上稀盐酸
C. 先用较多的水冲洗,再涂上硼酸溶液
D. 立即送医院
5.下列关于摩尔质量的叙述正确的是 ( )
A. 摩尔质量是1 mol物质的质量 B. 摩尔质量是物质式量的6.02×1023倍
C. 二氧化碳的摩尔质量是44 D. 摩尔质量的单位是mol
二、选择题(每小题有1~2个选项符合题意。本题包括10小题,每小题3分,共30分。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
6.下列关于碱金属的描述正确的是 ( )
A. 硬度小,密度小,熔沸点低
B. 碱金属都可以保存在煤油中
C. 金属在空气中燃烧都生成过氧化物
D. 其最高氧化物对应的水化物是碱
7.相同质量的下列物质,放入相同体积的过量水中,所得溶液的溶质质量分数最大的是 ( )
A. Na B. Na2O C. NaOH D. Na2O2
8.对于质量相同的O2和O3,下列说法正确的是 ( )
A. 分子数相同 B. 原子数相同
C. 同温同压时,体积比是3∶2 D. 同温同压时,密度比是1∶1
9.漂白粉有漂白性的原因是 ( )
A. Ca(ClO)2能产生HClO,HClO有强氧化性
B. Ca(ClO)2本身有漂白作用
C. CaCl2本身有漂白作用
D. Ca(ClO)2能产生Cl2
10.铝、锌、铁各1 mol,与足量盐酸反应,放出氢气的物质的量之比是 ( )
A. 3∶2∶2 B. 2∶3∶3 C. 1∶1∶1 D. 2∶3∶2
11.下列叙述中,正确的是 ( )
A. CO2的水溶液导电能力较弱,故CO2属于弱电解质
B. 氯化氢在水中的电离情况表明,其分子中存在H+ 和Cl-
C. 强电解质溶液的导电能力强于弱电解质
D. 水是一种极弱的电解质
12.下列反应的离子方程式不能用Ag++Cl- =AgCl↓表示的是 ( )
A. AgNO3+HCl=AgCl¯+HNO3
B. AgNO3+NaCl=AgCl¯+NaNO3
C. Ag2CO3+2HCl=2AgCl+CO2+H2O
D. AgNO3+KCl=AgCl¯+KNO3
13.下列实验选择的方法正确的是 ( )
A. 用氢氧化钠溶液除去CO2气体中混有的氯化氢气体
B. 用酒精从碘水中提取单质I2
C. 用过滤的方法分离MnO2和KCl的混合物
D. 用结晶的方法分离NaCl和KNO3的混合物
14.下列各组中的离子,能在无色溶液中大量共存的是 ( )
A. Na+ 、H+、![]() 、
、![]() B. Ca2+、K+、OH-、
B. Ca2+、K+、OH-、![]()
C. Ba2+、Cu2+、Cl-、OH-
D. Fe3+、H+、Cl-、![]()
15.某物质灼烧时,焰色反应为黄色,下列判断正确的是 ( )
A. 该物质一定是钠的化合物
B. 该物质一定含钠元素
C. 该物质一定是金属钠
D. 不能确定该物质中是否含有钾元素
三、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意。)
16.设NA为阿伏加德罗常数,下列说法中正确的是 ( )
A. 通常情况下,5.6 L氢气含有0.5 NA个氢原子
B. 9 g水含有的质子数为4 NA
C. 0.1 mol / L氯化钡溶液中Cl- 数目为0.2 NA
D. 2.4 g镁转化为镁离子时,失去0.2 NA个电子
17.在标准状况下,a L NH3溶于b mL水中,得到密度为r g / cm3的氨水,则此氨水的物质的量浓度为 ( )
A. ![]() mol / L
B.
mol / L
B. ![]() mol / L
mol / L
C. ![]() mol / L
D.
mol / L
D. ![]() mol / L
mol / L
18.实验室常用浓盐酸与二氧化锰反应制取氯气,该反应中还原剂与氧化剂的质量比是
( )
A. 146∶87 B. 73∶87 C. 87∶146 D. 87∶73
19.A2、B2、C2三种单质和它们的离子间能发生下列反应:2A-+C2=2C-+A2,2C-+B2=2B-+C2,X-能与C2发生如下反应:2X-+C2=2C-+X2,则下列有关判断中,错误的是
( )
A. 氧化性:B2>C2>A2 B. 还原性:X->C->B-
C. X2与B-能发生反应 D. X2与B-不能发生反应
20.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以碘酸钾(KClO3)形式存在。已知溶液中![]() 和I-发生反应:
和I-发生反应:
![]() +5I-+6H+ =3I2+3H2O
+5I-+6H+ =3I2+3H2O
根据此反应,可用试纸和一些生活中常见的物质进行试验,证明食物中存在![]() 。可供选用的物质有:① 自来水;② 蓝色石蕊试纸;③ 碘化钾淀粉试纸;④ 淀粉;⑤ 食糖;⑥ 食醋;⑦ 白酒,进行上述实验时,必须使用的物质是 ( )
。可供选用的物质有:① 自来水;② 蓝色石蕊试纸;③ 碘化钾淀粉试纸;④ 淀粉;⑤ 食糖;⑥ 食醋;⑦ 白酒,进行上述实验时,必须使用的物质是 ( )
A. ①③ B. ③⑥ C. ②④⑥ D. ①②④⑤⑦
第Ⅱ卷 (共40分)
四、(本题包括2小题,共15分)
21.用质量分数为98%、密度为1.84 g / cm3的浓硫酸配制200 mL 0.5 mol / L的硫酸溶液,请按要求填空:
(1) 所需浓硫酸的体积为 mL(精确到小数点后一位)。
(2) 下列实验操作中,对实验结果无影响的是 ,使实验结果偏大的是 ,使实验结果偏小的是 。
A. 量取浓硫酸读数时仰视量筒刻度线
B. 容量瓶洗涤后未干燥
C. 在烧杯内溶解溶质,搅拌时不慎溅出少量溶液
D. 未将洗涤液转移到容量瓶
E. 定容时,俯视刻度线
F. 振荡、摇匀溶液后,发现液面低于刻度线,再补加水到容量瓶刻度处
G. 配制好溶液倒入未干燥的试剂瓶中保存
22.下图是实验室制取、提纯氯气及研究氯气性质的装置图。
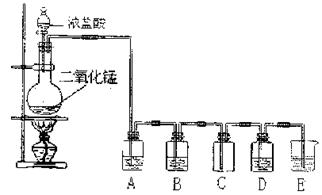 |
请回答:
(1) 实验室如果要制得干燥纯净的氯气,A、B瓶所装的试剂分别为: 和
。
(2) 证明C瓶中收集到干燥氯气的方法是 。
(3) 如果D瓶中装有AgNO3溶液,则观察到现象是 。
(4) E装置的作用是 ,所装试剂是 。
五、(本题包括2小题,共14分)
23.将过量的二氧化碳气体通入苛性钾溶液中,然后将反应后的溶液分成三份,分别加入硝酸、石灰水、氯化钙溶液。能反应的写出离子方程式,不能反应的说明理由。
①
②
③
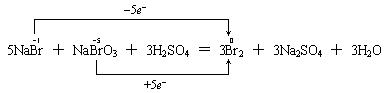
24.标出下列氧化还原反应中电子转移的方向和数目,并按要求填空。
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
氧化剂 ,氧化产物 。
2![]() +5H2O2+6H+ =2Mn2++5O2+8H2O
+5H2O2+6H+ =2Mn2++5O2+8H2O
还原剂 ,还原产物 。
六、(本题包括2小题,共11分)
25.将1.12 L(标准状况)的氯气通入500 mL、浓度为0.4 mol / L的KBr溶液中,充分反应后,将溶液蒸干得固体。求固体的成分及成分的质量。
26.将101 kPa、150℃状态下的CO2和H2O混合气体8.4 g,通入足量的Na2O2中,可得O2(标准状况)2.8 L,求原混合气体中CO2与H2O的物质的量。
答 案
一、1. B 2. B 3. D 4. C 5. A
二、6. AD 7. A 8. BC 9. A 10. A 11. D 12. C 13. CD 14. A 15. BD
三、16. D 17. A 18. B 19. C 20. B
四、21. (7分)(1) 5.4 mL(精确位数多取或少取都不给分;若取5.5 mL或6 mL都不给分) (2) B(2分);AE(2分); CDFG(2分,漏选1~4项只给1分)
22. (8分)(1) 饱和食盐水(1分,填蒸馏水、水不扣分);浓硫酸(或浓H2SO4)(1分,填硫酸或H2SO4均给分,填无水硫酸铜或无水CuSO4均不给分)(若A、B瓶试剂顺序填错了不给分)
(2) 干燥有色布条(1分),布条不褪色则证明收集的氯气是干燥的(1分,放入干燥蓝色石蕊试纸、沾有红墨水的干燥滤纸等均给分,但无“干燥”二字不给分;若未写“则证明收集的氯气是干燥的”仍给分)
(3) 出现白色沉淀(2分,无“白色”只给1分;若写成“白色¯”可给2分;若填成任何别的颜色的沉淀均不给分;若只填白色而无“沉淀”二字不给分)
(4) 吸收多余氯气(1分,无“多余”二字不给分;填吸收剩余氯气、未反应氯气、余气、尾气等均给分); NaOH(1分,若填其它强碱溶液、强碱名称或强碱化学式也给分;填Ca(OH)2、氢氧化钙或澄清石灰水也给分;填氨水不给分;填饱和碳酸钠溶液可考虑给分)
五、23. (6分)① 能与硝酸反应:![]() +H+=CO2+2H2O(2分,未写能与硝酸反应但化学方程式正确的给全分;任一化学式错误全扣;未写CO2向上箭头而其余全对只给1分)
+H+=CO2+2H2O(2分,未写能与硝酸反应但化学方程式正确的给全分;任一化学式错误全扣;未写CO2向上箭头而其余全对只给1分)
② 能与石灰水反应:![]() +Ca2++OH-=CaCO3¯+H2O或2
+Ca2++OH-=CaCO3¯+H2O或2![]() +Ca2++2OH-=CaCO3¯+2H2O +
+Ca2++2OH-=CaCO3¯+2H2O +![]() (2分,未写能与石灰水反应但化学方程式正确的给全分;任一化学式错误全扣;未写CaCO3向下箭头而其余全对只给1分)
(2分,未写能与石灰水反应但化学方程式正确的给全分;任一化学式错误全扣;未写CaCO3向下箭头而其余全对只给1分)
③ 不能与氯化钙反应,因为无沉淀、气体或弱电解质生成(2分,填成无沉淀、气体或水生成不扣分;填成不符合复分解反应条件给1分;只写了三个条件中的两个或一个给1分)
24. (8分)
(只写得、失电子总数未写降低、还原、升高、氧化的不扣分;单线桥法正确的不扣分;只写得失电子且正确但未写电子数给1分;只写电子数且正确但未写得、失给1分)
NaBrO3(1分,写名称且正确的不扣分;写不扣分;只写Br不给分); Br2(1分,写名称且正确的不扣分;只写Br不给分;写3Br2不扣分)
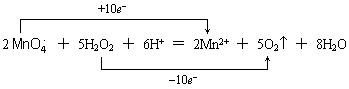
(评分参考上题)
H2O2(1分,写名称且正确的不扣分;写不扣分;写5H2O2不扣分);Mn2+(写离子名称且正确的不扣分;写2Mn2+不扣分;写Mn不给分)
六、25. (5分)标准状况下,1.12 L氯气为0.05 mol,KBr为0.2 mol,
由Cl2+2KBr=2KCl+Br2(1分)知KBr过量,应以Cl2计算有关量(1分)。
n(KCl)=2n(Cl2)=0.1 mol,
m(KCl)=0.1 mol×74.5 g / mol=7.45 g,(1分)
n(反应KBr)=2n(Cl2)=0.1 mol,(1分)
n(剩余KBr)=0.2 mol-0.1 mol=0.1 mol,
m(剩余KBr)=0.1 mol×119 g / mol=11.9 g,(1分)
26.(6分)2.8 L标准状况下的氧气为0.125 mol,设原混合气体中CO2和H2O的物质的量分别为2x、2y,
![]()
![]() 2Na2O2 +
2CO2 = 2Na2CO3 + O2
2Na2O2 +
2CO2 = 2Na2CO3 + O2
2x x
2Na2O2 + 2H2O = 4NaOH + O2↑ (2分,化学方程式任一错误不给分)
2y y
8.4 g 0.125
![]() 2x×44 g / mol+2y×18 g / mol=8.4 g
2x×44 g / mol+2y×18 g / mol=8.4 g
x+y=0.125 mol (两个方程式全对才给2分)
![]() x=0.15 mol (1分)
x=0.15 mol (1分)
y=0.1 mol (1分)
(用关系式法且正确的不扣分;也可以用质量单位计算:计算结果无单位但数据正确的答案给1分;用十字交叉法不给分;用平均式量法计算且正确给全分)