高一年级化学第一学期学科期中考试试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间100分钟。将第I卷答案填涂在答题卡上。
第Ⅰ卷(选择题 共54分)
可能用到的相对原子质量:H-1 C―12 O―16 Na―23
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意。)
1.2003年10月15日上午,我国成功地发射了“神舟五号”载人航天飞船,并于16日晨成功回收,成为继俄罗斯、美国后第三个能够发射载人航天器的国家,备受世界瞩目。这次发射的成功,归功于我国科学家多年来不懈的努力,化学工作者也功不可没。下列成就(成果)不是我国科学家取得的是
A.第一架载人航天飞船的升空
B.世界上第一次用化学方法合成具有生物活性的蛋白质——结晶牛胰岛素
C.世界上首次人工合成具有与天然分子相同化学结构与完整生物活性的核糖核酸
D.发明将合成氨和纯碱两种产品联合生产的“联合制碱法”
2.下列元素在自然界中没有游离态存在的是
A.氧 B.氮 C.钠 D.氦
3.下列物质溶于水后都能导电,其中属于强电解质的是
A.SO3 B.Cl2 C.NaOH D.CH3COOH
4.在四种基本反应类型中,一定是氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
5.下列反应既属于氧化还原反应,又是吸热反应的是
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2的反应 D.木炭在氧气中的燃烧反应
6.点燃时,锂与氧气反应后生成的化合物是
A.LiO B.Li2O C.Li2O2 D.LiO2
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
7.在两支试管中分别加入3mL稀盐酸(含HCl的物质的量相等),同时向两支试管加入足量的Na2CO3粉末和NaHCO3粉末,下列说法中正确的是
A.加NaHCO3粉末的试管中产生二氧化碳气体的速率快
B.两支试管中产生二氧化碳气体的速率一样快
C.加NaHCO3粉末的试管中产生二氧化碳气体的体积大
D.两支试管中产生二氧化碳气体的体积一样大
8.除去Na2CO3固体中混有的少量NaHCO3固体的最佳方法是
A.加入盐酸 B.通入CO2
C.加热至炽热 D.加入NaOH溶液
9.已知某温度下发生如下三个反应:
① C+CO2=2CO
② C+H2O=CO+H2
③ CO+H2O=CO2+H2
由此判断,在该温度下C、CO、H2的还原性的强弱顺序是
A.CO>C>H2 B.C>CO>H2
C.C>H2>CO D.CO>H2>C
10.用NA表示阿伏加德罗常数,下列说法不正确的是
A.0.012 kg 12C中所含碳原子数为NA
B.0.1 mol Na+中所含电子数为NA
C.40 g NaOH中所含Na+数为NA
D.1 mol H2完全燃烧时转移电子数为NA
11.不能用离子方程式H++OH-=H2O表示的化学反应是
A.盐酸和氢氧化钠溶液 B.硫酸溶液和氢氧化钡溶液
C.硝酸溶液和氢氧化钡溶液 D.醋酸溶液和氢氧化钠溶液
12.金属钠比金属钾
A.熔点高 B.原子半径大 C.金属性强 D.还原性强
13.关于钠的用途,下列叙述不正确的是( )
A.高压钠灯发出黄光射程远,用于照明
B.钠可以用来制取过氧化钠等化合物
C.钠、钾合金可用于原子反应堆的导热剂
D.钠可将钛、锆、铌等金属从它们的水溶液中置换出来
14.某同学用以下方法制取CuO:称取5g胆矾![]() 胆矾粉末
胆矾粉末![]() CuSO4溶液
CuSO4溶液![]() 含Cu(OH)2的悬浊液
含Cu(OH)2的悬浊液![]() 含CuO的悬浊液
含CuO的悬浊液![]() CuO,然后用制得的CuO作催化剂使KClO3分解制取并收集氧气。制取CuO的步骤中要用玻璃棒的是
CuO,然后用制得的CuO作催化剂使KClO3分解制取并收集氧气。制取CuO的步骤中要用玻璃棒的是
A.②⑤ B.②④⑤ C.②③④⑤ D.①②③④⑤
15.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得(SO32-被氧化为SO42-),在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
第Ⅱ卷(非选择题 共46分)
 三、(本题包括2小题,共12分)
三、(本题包括2小题,共12分)
16.(6分)回答下列问题:
⑴现有下列实验用品:烧杯、镊子、滤纸,要顺利、安全地做好钠与水反应的实验,还需要的实验用品是 。
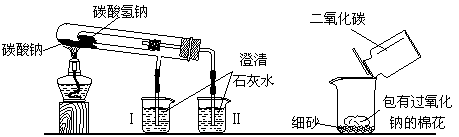
⑵用下左图装置(铁架台略去未画)比较Na2CO3和NaHCO3的稳定性,可以看到烧杯Ⅱ中有沉淀生成,说明
较稳定,原因是______________
_______________________________。
 ⑶用上右图方法验证Na2O2与CO2的反应,发现包有Na2O2的棉花燃烧。该实验说明CO2的密度比空气_________(填“大”、“小”),该反应是一个__________(填“放热”、“吸热”)反应。
⑶用上右图方法验证Na2O2与CO2的反应,发现包有Na2O2的棉花燃烧。该实验说明CO2的密度比空气_________(填“大”、“小”),该反应是一个__________(填“放热”、“吸热”)反应。
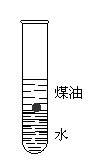
17.(6分)为了探究金属钠的物理性质及化学性质,某学生设计了如右图所示的实验。他在试管中先加入少量水,然后沿试管壁缓慢加入少量煤油,静置待其分层后,加入一小块金属钠,观察到金属钠在煤油层中一会儿上浮,一会儿下沉。试回答:
⑴该实验说明钠的密度比煤油_____________,比水___________;
⑵金属钠与水接触后在煤油层中上浮,原因是_____________________
_________________________________________________________________
____________________________________________;
⑶金属钠浮到煤油层表面后又下沉,原因是________________________
__________________________________________________________________
____________________________________________。
四、(本题包括2小题,共10分)
18.(5分)下面的表和图分别是近几年中国能源消费和万元国内生产总值能耗的有关数据,其中能源的消耗都折算成标准煤。
表:1990年~2000年中国能源消费总量及构成
| 年份 | 能源总量 | 占能源总量及构成(%) | |||
| (万吨标准煤) | 煤炭 | 石油 | 天然气 | 电力 | |
| 1990 | 98703 | 76.2 | 16.6 | 2.1 | 5.1 |
| 1992 | 109170 | 75.7 | 17.5 | 1.9 | 4.9 |
| 1994 | 122737 | 75.0 | 17.4 | 1.9 | 5.7 |
| 1996 | 138948 | 74.7 | 18.0 | 1.8 | 5.5 |
| 1998 | 132214 | 69.6 | 21.5 | 2.2 | 6.7 |
| 2000 | 128000 | 67.0 | 23.6 | 2.5 | 6.9 |
图:1985年~2000年中国万元国内生产总值能耗
|
|
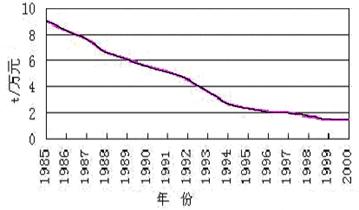
从上面的图和表可以看出:
⑴我国目前的能源消费仍然以____________为主;
⑵我国万元国内生产总值能耗逐年__________,这说明我国对能源的利用率逐年___________;
⑶请写出提高煤炭利用率的一种措施________________________________。
19.(5分)标出下列反应中电子转移的方向和数目
Fe + Cu2+ = Fe2+ + Cu
该反应中,氧化剂是______________,还原剂是____________,氧化性的强弱顺序是Cu2+_______Fe2+(用“>”或“<”填空,下同),氧化性的强弱顺序是Cu_______Fe。
 五、(本题包括2小题,共12分)
五、(本题包括2小题,共12分)
20.(6分)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
 |
从实验可以判断:
⑴该固体粉末中一定不含有 ;
⑵该固体粉末中一定含有 和 ;
⑶它的第三种成分只能是______________或 _ ____ ____中的一种。
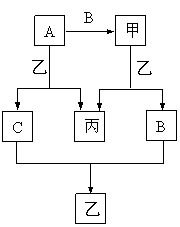 |
21.(6分)已知A、B、C是单质,甲、乙、丙是化合物,其中B、C常温下呈气态,乙常温下呈液态,其他为固态。又知丙的焰色反应呈黄色,其水溶液呈碱性。它们之间存在如下转化关系。
⑴写出A和B反应的化学方程式________________________________;
⑵写出A和乙反应的离子方程式________________________________;
⑶写出甲和乙反应的离子方程式________________________________。
六、(本题包括2小题,共12分)
22.(5分)设钠原子的质量为m(Na),12C原子的质量为m(12C),阿伏加德罗常数为NA,试证明钠的相对原子质量[Ar(Na)]在数值上等于以g/mol为单位的摩尔质量[M(Na)]。
提示:从阿伏加德罗常数、相对原子质量和摩尔质量的定义入手。
23.(7分)在一定条件下,使CO和O2的混合气体30 g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重14 g。求:
⑴原混合气体中O2和CO的质量。
⑵原混合气体中O2和CO的物质的量。
高一年级化学第一学期学科
期中考试试题参考答案
一、选择题(本题包括6小题,每小题3分,共18分。)
1.A 2.C 3.C 4.D 5.D 6.B
二、选择题(本题包括9小题,每小题4分,共36分。)
7.AC 8.C 9.B 10.D 11.BD 12.A 13.D 14.B 15.B
三、(本题包括2小题,共12分)
16.⑴小刀、玻璃片 (2分) ⑵Na2CO3 Na2CO3直接受热却没有NaHCO3间接受热易分解 (2分) ⑶大 放热 (2分)
17.⑴大 小 (2分) ⑵金属钠与水反应生成了氢气,附着在钠表面,增大了钠的浮力。 (2分) ⑶金属钠浮到煤油层表面后,氢气逸散到空气中,使钠的浮力减小。 (2分)
四、(本题包括2小题,共10分)
18.⑴煤炭(或化石能源) (1分) ⑵降低 (1分) 提高 (1分) ⑶使煤充分燃烧、煤的气化、煤的液化等(2分)
 19.
19.
Cu2+ Fe > < (各1分,共5分)
五、(本题包括2小题,共12分)
20. CuSO4(2分) CaCO3 KNO3(2分) Na2SO4 BaCl2(2分)
(写物质名称同样得分)
21.⑴2Na+O2![]() Na2O2 ⑵2Na+2H2O=2Na++2OH-+H2↑ ⑶2Na2O2+2H2O=4Na++4OH-+O2↑ (各2分,共6分)
Na2O2 ⑵2Na+2H2O=2Na++2OH-+H2↑ ⑶2Na2O2+2H2O=4Na++4OH-+O2↑ (各2分,共6分)
六、(本题包括2小题,共12分)
22.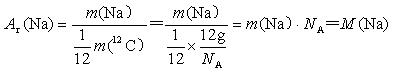
(1分) (2分) (1分) (1分)
23.⑴Na2O2+CO![]() Na2CO3 CO被吸收完全,故m(CO)=14
g (2分)
Na2CO3 CO被吸收完全,故m(CO)=14
g (2分)
∴ m(O2)=30 g ―14 g=16 g (1分)
⑵n(CO)=![]() (2分) n(O2)=
(2分) n(O2)=![]() (2分)
(2分)