高一年级化学综合检测试题(二)
一、选择题
![]()
![]()
![]() 1.1992年,我国十大科技成就之一是 Pt、 Hf、 Hg、三种新的核素首次合成。它们的中子数依次为 ( )
1.1992年,我国十大科技成就之一是 Pt、 Hf、 Hg、三种新的核素首次合成。它们的中子数依次为 ( )
A.78、72、80 B.124、113、128
C.202、185、208 D.280、257、288
2.下列属于新型无机非金属材料的是 ( )
A.光导纤维 B.景泰蓝 C.光学玻璃 D.氮化硅陶瓷
3.质量相同的Na和K,分别与足量的水反应,正确的叙述是 ( )
A.反应过程中,二者均能浮在水面上 B.放出H2的体积相同
C.生成碱溶液的质量分数相同 D.反应的剧烈程度不同
4.下列指定原子序数的元素,可能形成AB3型化合物的是 ( )
A.12和7 B.16和8 C.9和3 D.5和9
5.在标准状况下,1 L Cl2中含n个Cl2分子,则阿伏加德罗常数可表示为 ( )
![]() A.22.4 n/mol B.22.4n
A.22.4 n/mol B.22.4n
![]() C. D. mol
C. D. mol
6.下列物质中,导电性最好的是 ( )
A.18.4 mol/L H2SO4 B.12 mol/L HCl
C.1 mol/L HCl D.2 mol/L CH3COOH
7.工业上由NaOH 溶液制固体烧碱,需在下列哪种容器中进行 ( )
A.陶瓷 B.玻璃 C.铁 D.铂
8.下列化学方程式,不能用Ag+ + Cl – = AgCl↓表示的是 ( )
A.Ag2CO3 + 2HCl = 2AgCl↓+ CO2↑+ H2O
B.AgNO3 + HCl = AgCl↓+ HNO3
C.AgNO3 + NaCl = AgCl↓+ NaNO3
D.2AgNO3 + MgCl2 = 2AgCl↓+ Mg(NO3)2
9.下列物质跟水反应,水既不是氧化剂,又不是还原剂的是 ( )
A.Na B.K C.Cl2 D.F2
10.根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
H2SO3 + I2 + H2O = 2HI + H2SO4
FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 = 2FeCl3 + NO↑+ 2H2O + Fe(NO3)3
A.H2SO3>I –>Fe2+>NO B.I –>Fe2+>H2SO3>NO
C.Fe2+>I –>H2SO3>NO D.NO>Fe2+>H2SO3>I –
11.下列离子方程式正确的是 ( )
A.Cl2通入水中:Cl2 + H2O = 2H+ + Cl – + ClO –
B.等体积等物质的量浓度的H2SO3和NaOH混合:
H2SO3 + 2OH – = 2H2O + SO32 –
C.Ba(OH)2溶液和盐酸混合:H+ + OH – = H2O
D.Cu投入HCl中:Cu + 2H+ = Cu2+ + H2↑
|
A.Cl2既是氧化剂,又是还原剂 ( )
B.KCl是氧化产物,KClO3是还原产物
C.氧化剂与还原剂的质量比为5∶1
D.氧化产物与还原产物的质量比为1∶5
13.在下列物质中,长期放置在空气中因为发生氧化还原反应而变质的是 ( )
A.CaO B.Na2CO3·10H2O
C.NaOH D.Na2O2
14.A、B、C三种元素的核外电子数都比氩原子少,A和C处于同一主族,A和B的核电荷数之差为5,B原子的M电子层比L电子层少两个电子,则A、B、C三元素分别为 ( )
A.Li、Na、S B.Na、S、Li C.Na、K、Br D.K、Br、Na
15.将50 mL 1.2 mol/L的盐酸缓慢滴入到足量MnO2固体中并加热,则被还原的HCl的物质的量为 ( )
A.= 0.15 mol B.>0.15 mol
C.0.15 mol ~ 0.3 mol D.0 mol
16.在溶液中能大量共存且溶液为无色的一组离子是 ( )
A.Na+、K+、CO32 –、Cl – B.Na+、Cu2+、SO42 –、Cl –
C.K+、I –、NO3 –、Ag+ D.H+、Mg2+、HCO3 –、Br –
17.将0.3 mol Na与0.1 mol S迅速混合起来,并放在石棉网上加热,反应后的固体产物是 ( )
A.S和Na2O2 B.S和Na2S C.Na2O2和Na2S D.Na2O和Na2S
18.商品“纯净水”、“太空水”、“蒸馏水”等作为日常饮用水,因缺少某些成分而不利于儿童身体健康,你认为制备上述商品饮用水时至少还需要添加的化学物质是
A.钙镁的碳酸氢盐 B.含碘酸钾的食盐 ( )
C.漂白粉消毒剂 D.小苏打
![]()
![]()
![]() 19.硼有两种天然核素 、 ,硼元素的相对原子质量为10.80,则对硼元素中 质量分数的判断正确的是 ( )
19.硼有两种天然核素 、 ,硼元素的相对原子质量为10.80,则对硼元素中 质量分数的判断正确的是 ( )
A.略小于20% B.略大于80%
C.20% D.80%
20.8.7 g MnO2和含HCl 14.6 g的浓盐酸共热来制取Cl2,有关叙述正确的是 ( )
A.可制得7.1 g Cl2 B.被氧化的HCl是14.6 g
C.被氧化的HCl是7.3 g D.制得的Cl2少于7.1 g
21.下列各组溶液,只用组内溶液互相反应的方法就可鉴别的是 ( )
A.NaOH、NaCl、FeCl3、MgCl2 B.Na2SO4、BaCl2、KNO3、NaCl
C.NaCl、AgNO3、NaNO3、HCl D.Na2SO4、Na2CO3、BaCl2、HCl
22.向盛有1 L水的A、B、C、D四个烧杯中分别加入等物质的量的钠、氧化钠、过氧化钠和氢氧化钠,固体完全溶解后,各烧杯中溶质的质量分数的顺序是 ( )
A.B = C>A>D B.D>C>B>A
C.B = C>A = D D.B>C>A>D
23.标况下把4.48 L CO2通过一定质量的固体过氧化钠后,收集到3.36 L气体(标况),这3.36 L气体的质量是 ( )
A.3.8 g B.5.6 g C.4.8 g D.6.0 g
24.用光洁的铂丝蘸取某无色溶液,在无色灯上灼烧时观察到黄色火焰,则下列有关叙述中正确的是 ( )
A.只含有Na+ B.一定含Na+,也可能含有K+
C.即含Na+又含K+ D.可能含Na+或K+的一种
25.2.1 g平均相对分子质量为7.2的CO和H2组成的混合气体与足量氧气充分燃烧后,立即将全部燃烧产物通入足量的Na2O2固体,固体质量增加 ( )
A.2.1 g B.3.6 g C.7.2 g D.8.4 g
26.a L标准状况下的H2、Cl2混合气体经光照,充分反应后,所得气体恰好使溶液中b mol NaOH完全转变为盐,则a、b的关系不可能为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
27.下列试剂中,可以确定某无色混合气体中一定含有SO2和CO2的是 ( )
①石灰水 ②品红试液 ③溴水 ④KMnO4酸性溶液
A.①④ B.③① C.①② D.②④①
二、填空题
28.有一无色溶液,只含Mg2+、K+、Cu2+、Cl–、SO32–、SO42–、I –、CO32 –中的一种,向其中滴入足量BaCl2溶液产生白色沉淀,滤出沉淀后加入足量盐酸,沉淀部分溶解并产生气体,此气体能使品红溶液褪色,再取上述滤液滴加用硝酸酸化的硝酸银溶液,产生白色沉淀。推断原溶液中肯定存在的离子有________,肯定不含有________离子,不能肯定是否含有的离子是________。
29.实验室利用下列仪器和药品,制取纯净的无水CuCl2,其中分液漏斗装有浓HCl,烧瓶中装有MnO2,a、b、c中分装三种液体,可供选择的药品有:浓H2SO4、水、饱和食盐水、KMnO4、NaOH、澄清石灰水,c为生成CuCl2的装置。
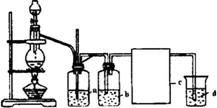 请填写下列空白:
请填写下列空白:
⑴写出制氯气的化学方程式:
______________________________
⑵安全瓶a可防止倒吸,且可检验反应进行时导气管是否堵塞,a瓶中应装________,发生堵塞时a瓶中的现象为________。
⑶仪器b中装__________,作用是__________;仪器d中装__________,反应的化学方程式为:______________________________。
⑷下列装置中可用于本实验生成CuCl2的是________。
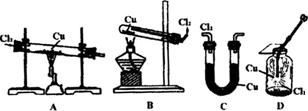 |
30.长期以来人们一直认为氟的含氧酸不存在,但在1971年美国科学家将F2通入细冰末时获得了次氟酸(HFO)。
⑴HFO的电子式为________,其中氧的化合价为________。
⑵已知HFO与水反应时,生成某物质A,A既可用作氧化剂,又可用作还原剂,且遇某常见黑色物质时,能迅速放出一种无色无味的气体,则HFO与水反应的方程式为:______________________________。生成物A与高锰酸钾溶液反应时,A作________(填氧化剂或还原剂)。
31.将NaBr溶液分成两份,一份加入AgNO3溶液,立即生成______色沉淀,该反应的离子方程式为______________________________,另一份通入足量Cl2,该反应的离子方程式为______________________________。
32.长期在玻璃瓶中存放的NaOH 溶液可能含有的杂质为______,原因是(写化学方程式)______________________________、______________________________。
33.在配制一定物质的量浓度溶液的实验中,下列操作对所配溶液浓度无影响的是__ (填序号);会使所配溶液的浓度偏小的是______。
A.在烧杯内溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁溶液转入容量瓶
C.容量瓶中所配溶液液面未到刻度线便停止加水
D.将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中有少量溅出
34.在1 L 1.0 mol/L的NaOH溶液中通入二氧化硫17.92 L(标况),得到溶液里
SO32 –与HSO3 –的物质的量之比是______。
35.有一种无色混合气体中可能含有CH4、NH3、H2、CO、CO2和HCl气体。进行如下实验:①此混合气体通过浓H2SO4气体总体积不变;②再通入澄清石灰水,气体体积变小但无浑浊现象;③剩余气体在空气中引燃,燃烧产物不能使无水硫酸铜变色。
⑴ 根据实验①,可推断混合气体中没有______,原因是____________________;
⑵ 根据实验③,可推断混合气体中没有______,原因是____________________;
⑶ 混合气体中肯定有____________;
⑷ 上述实验______(填“有”或“没有”)不能肯定或否定的气体。若有,则是______气体。
三、计算题
36.白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙三份质量不同的A样品分别与50.0 mL相同浓度的盐酸充分反应,得到气体的体积(标准状况)与A的质量关系如下表:
| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸的体积(mL) | 50.0 | 50.0 | 50.0 |
| A样品的质量(g) | 2.84 | 5.25 | 7.00 |
| 气体的体积(L) | 0.672 | 0.896 | 0.896 |
试计算:
⑴ 该盐酸的物质的量浓度。
⑵ 混合物中NaHCO3的质量分数。
37.400 mL某浓度的NaOH溶液恰好与5.6 L Cl2(标况)完全反应,计算:
⑴ 生成NaClO的物质的量;
⑵ 该溶液中NaOH的物质的量浓度。
综合检测试题(二)参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | AD | AD | BD | A | B | C | A | C | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | AC | D | B | D | A | C | A | B | D |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | |||
| 答案 | AD | A | D | B | A | D | D |
二、填空题
28.SO32–、SO42–、K+;Cu2+、I–、Mg2+;CO32–、Cl–;
29.⑴ MnO2 + 4HCl(浓)= MnCl2 + Cl2↑+ 2H2O;(请制作人员将左边的等号换为加热符号,谢谢!)
⑵ 饱和食盐水;玻璃管中液面上升;
⑶ 浓H2SO4;吸水;NaOH溶液;2NaOH + Cl2 = NaClO + NaCl + H2O;
![]()
![]()
![]()
![]() ⑷ A、B。
⑷ A、B。
30.⑴ H∶O∶F∶;0价;
⑵ HFO + H2O = HF + H2O2,还原剂;
31.淡黄;Ag+ + Br– = AgBr↓;Cl2 + 2Br– = 2Cl– + Br2。
32.Na2CO3、Na2SiO3;2NaOH + CO2 = Na2CO3 + H2O;
2NaOH + SiO2 = Na2SiO3 + H2O。
33.D;AB。
34.1∶3。
35.⑴ NH3;浓硫酸吸收氨气;
⑵ H2、CH4;H2和CH4燃烧都有水生成,可以使无水CuSO4变蓝;
⑶ CO和HCl
⑷ 有;CO2。
三、计算题
36.⑴ 0.040 mol;
⑵ 29.6%。
37.⑴ 0.25 mol;
⑵1.25 mol/L。