高一年级化学综合检测试题(一)
一、选择题(只有1个选项符合题意)
1.下列反应一定属于氧化还原反应的是 ( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
2.下列各组离子在溶液中能大量共存的是 ( )
A.Mg2+、Cl–、H+、SO42– B.H+、HCO3–、Na+、Cl–
C.Na+、OH–、Ba2+、CO32– D.K+、Cl–、NO3–、Ag+
3.下列反应不是放热反应的是 ( )
A.铁粉和稀硫酸反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.木炭在空气中燃烧 D.盐酸与烧碱溶液反应
4.下列溶液中Cl–的浓度与50 mL 1 mol/L的AlCl3溶液中的Cl–的浓度相等的是 ( )
A.150 mL 1 mol/L氯化钾 B.75 mL 2 mol/L氯化镁
C.150 mL 1 mol/L氯化钙 D.75 mL 1 mol/L氯化铝
5.200 mL 0.3 mol/L的硫酸溶液与100 mL 0.6 mol/L的硫酸溶液混合后(假设混合后体积不变),溶液的物质的量浓度是 ( )
A.0.045 mol/L B.0.6 mol/L C.0.4 mol/L D.0.3 mol/L
6.将一小块金属钠露置于空气中,最后生成物是 ( )
A.Na2O B.Na2O2 C.NaHCO3 D.Na2CO3
7.下列离子方程式不正确的是 ( )
A.二氧化锰和盐酸制氯气
|
B.氯气和水反应
H2O + Cl2 = H+ + Cl– + HClO
C.氢氧化钠溶液吸收氯气
2OH– + Cl2 = Cl– + ClO– + H2O
D.漂白粉和盐酸
Ca(ClO)2 + 2HCl = Ca2+ + 2Cl– + 2HClO
8.设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.17 g NH3所含电子数目为NA
B.3.9 g钾变成钾离子时失去的电子数为0.1NA
C.常温常压下,11.2 L Cl2所含原子数目为NA
D.32 g O2所含氧原子数目为NA
二、选择题(每小题有1或2个选项符合题意)
9.下列物质容易导电的是 ( )
A.熔融氯化钠 B.硝酸钾溶液 C.硫酸铜晶体 D.无水乙醇
10.如果要求100个水分子中溶有1个钠离子,可以将1.15 g金属钠放入质量为多少的水中 ( )
A.115 g B.100 g C.90.9 g D.90 g
11.将20.8 g两种金属的混合物投入足量的盐酸中,待反应完全后得到氢气11.2 L(标准状况),该混合物的组成可能是 ( )
A.铝和镁 B.钙和锌 C.锌和钡 D.镁和铜
12.同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是 ( )
A.密度比为16∶11 B.密度比为11∶16
C.体积比为1∶1 D.体积比为11∶16
13.在A、B、C三支试管中分别盛有Cl–、Br–、I–的溶液,向A试管中加入淀粉溶液和氯水,溶液变成橙黄色,再将此溶液倒入C试管中无变化,则A、B、C试管中分别含有的离子依次是 ( )
A.I–、Br–、Cl– B.Br–、Cl–、I– C.Cl–、I–、Br– D.Br–、I–、Cl–
14.除去氯气中混有的水蒸气和氯化氢气体,可使气体依次通过的洗气瓶是 ( )
A.浓硫酸、水 B.饱和食盐水、浓硫酸
C.烧碱、生石灰 D.无水氯化钙、烧碱
|
A.5∶1 B.4∶1 C.1∶5 D.1∶4
16.同温同压下,10 mL气体A2和30 mL气体B2完全反应可生成20 mL气体C,则C的化学式为 ( )
A.A2B6 B.A2B3 C.A3B D.AB3
17.KOH溶液中溶质的质量分数为14%,加热蒸发掉100 g水后变成溶质质量分数为28%的KOH溶液80 mL,则后者溶液的物质的量浓度可能是 ( )
A.6 mol/L B.6.75 mol/L C.6.25 mol/L D.5.5 mol/L
18.将一小粒金属钾投入下列物质中,既能产生气体又能产生沉淀的是 ( )
A.稀H2SO4 B.BaCl2溶液
C.Ca(HCO3)2溶液 D.FeCl3溶液
19.A、B、C、D四个集气瓶中装有Cl2、H2、HCl、HBr中任一种气体,若将A和D两种气体混合,见光会爆炸;若将A和B混合,瓶壁上会出现暗红色小液滴,则C瓶装的气体是 ( )
A.H2 B.HCl C.HBr D.Cl2
20.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐中必须加碘,其中的碘以碘酸钾(KIO3)形式存在,己知溶液中IO3–和I–发生反应:IO3– + 5I– + 6H+ = 3I2 +3H2O,据此反应,可用试纸和生活中常见的物质进行实验,证明食盐中存在IO3–,可供选择的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行以上实验时必须使用的物质是 ( )
A.①② B.③⑥ C.②④⑥ D.①②③④⑤⑥⑦
21.下列物质具有漂白作用的是 ( )
A.干燥氯气 B.KI溶液 C.次氯酸钙溶液 D.过氧化钠
22.将5 mL 10 mol/L的H2SO4稀释到250 mL,取出10 mL,则此10 ml稀溶液中H+物质的量浓度是 ( )
A.0.2 mol/L B.0.4 mol/L C.0.5 mol/L D.1 mol/L
23.下列各组溶液,不用其他试剂,就可以将它们区别开的是 ( )
A.盐酸、氢氧化钠、碳酸钠、硫酸钠
B.盐酸、硝酸银、氢氧化钠、硝酸钠
C.氢氧化钠、硫酸镁、碳酸钠、硫酸氢钠
D.氯化钠、硫酸钠、氯化钙、硝酸钙
24.把含有某一种氯化物杂质的氯化镁粉末95毫克溶于水后,与足量的硝酸银溶液反应,生成氯化银沉淀300毫克,则该氯化镁中的杂质可能是 ( )
A.氯化钠 B.氯化铝 C.氯化钾 D.氯化钙
三、填空题
25.工业上生产漂白粉是通过________和________作用制成的,其化学反应方程式为:____________________,漂白粉的有效成分是________,用化学方程式表示漂白粉在空气中漂白的原理____________________,在漂白粉中加入少量盐酸,可增强漂白作用,其原因是____________________。
26.在同温同压下,体积比为3∶2的氧气和臭氧(O3),它们的物质的量之比为______,质量比是________,密度比是________,原子个数比是________,若将它们按3∶2(体积比)混合在一起,混合气体的平均相对分子质量是氢气的______倍。
27.12.4 g Na2X中,含0.4 mol Na+,则Na2X的摩尔质量是______,X的相对原子质量为______,该物质的化学式是________。
四、实验题
28.实验室用下列装置制取氯气,并进行后面的实验,请回答下列问题:
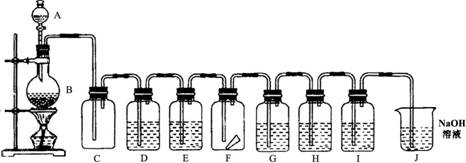 |
⑴A、B各放什么物质?
A:______ B:______,化学方程式为: 。
⑵储气瓶C中现象是________。
⑶装置D是为了除去Cl2中的氯化氢气体,D中应放下列溶液中的______。
A.NaOH溶液 B.水 C.AgNO3溶液 D.饱和食盐水
⑷E装置是为了使氯气干燥,装置中应放入下列中的______。
A.NaOH溶液 B.碱石灰 C.浓H2SO4 D.饱和食盐水
⑸ F装置中为湿润红布条,观察到的现象是________,原因是________。
⑹ G装置中放入石蕊试液,观察到的现象是________,原因是________。
⑺ H装置中放入NaBr溶液,观察的现象是______,反应的化学方程式为______。
⑻ I装置中放入KI淀粉溶液,观察到的现象是________,原因是________。
⑼ J装置中放入NaOH溶液的作用是________,反应的化学方程式是__________。
五、计算题
29.现有K2SO4和H2SO4的混合溶液100 mL,其中K2SO4的物质的量浓度为0.5 mol/L,H2SO4的物质的量浓度为1 mol/L,现要求将上述混合溶液中K2SO4的浓度改变为0.2 mol/L,H2SO4的浓度改变为2 mol/L,应加入98%(密度是1.84 g/cm3)的硫酸多少毫升?
30.将305 g NaHCO3和Na2CO3的混合物加热至质量不再减少为止,待冷却后,称得剩余固体质量为212 g,则原混合物Na2CO3的质量分数是多少?
综合检测(一)参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | A | B | D | C | D | D | B |
二、选择题
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | AB | C | BD | AD | D | B | A | D |
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 | C | CD | B | B | CD | B | BC | D |
三、填空题
25.Cl2,石灰乳 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
次氯酸钙 Ca(ClO)2 + H2O + CO2 = CaCO3 + 2HClO
Ca(ClO)2 + 2HCl = CaCl2 + 2HClO 反应生成次氯酸
26.3∶2;1∶1;2∶3;1∶1;19.2
27.62 g/mol;16;Na2O
四、实验题
|
⑵有黄绿色气体出现
⑶D
⑷C
⑸红色褪去;氯气遇到潮湿的物质后有HClO生成,HClO有漂白作用
⑹紫色先变红后又变为无色;Cl2与水反应生成盐酸和次氯酸,盐酸使石蕊变红;HClO的强氧化性能漂白有色物质,使石蕊褪色
⑺溶液由无色变成黄色;2NaBr + Cl2 = 2NaCl + Br2
⑻溶液由无色变成蓝色;2KI + Cl2 = 2KCl + I2,生成的碘使淀粉变蓝
⑼吸收多余的氯气;Cl2 + 2NaOH = NaCl + NaClO + H2O
五、计算题
29.21.7 mL
30.原混合物中碳酸钠的质量分数为17.4%。