高一年级上学期化学期末考试试卷
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
(考试时间:90分钟,总分:100分)
相对分子质量:H--1,O—16,C—12,S—32,N—14,Na—23,Cl—35.5,
Ag—108,Mn—55,Al--27
一、 选择题:(本题共20小题,1—10小题每题2分,11—20小题每小题3分,共50分,每题只有一个正确答案)
1、 下列物质属于纯净物的是( )
A、氯水 B、液氯 C、钢 D、漂粉精
2、 在同温同压下,10mL气体A2和30mL气体B2完全反应可生成20mL气体C,则C的化学式为( )
A、A2B6 B、A2B3 C、A3B D、AB3
3、 钾、钠合金(含50%—80%钾)可作原子反应堆的导热剂,下面有关该合金的事实与此应用无关的是( )
A、熔点260.7K B、具有很高的比热 C、可作冷却剂
D、能跟水剧烈反应
4、 区别氯气和氯化氢可以选用( )
A、AgNO3溶液 B、Na2CO3溶液 C、淀粉溶液 D.石蕊试液
5、能用“CO32-+2H+=CO2↑+H2O”表示的离子反应是( )
A.Na2CO3溶于醋酸 B.K2CO3溶于稀H2SO4
C.BaCO3溶于盐酸 D.NaHCO3溶于稀H2SO4
6、在反应3S+6KOH=2K2S+K2SO3+3H2O中还原产物是( )
A.S B.KOH C.K2S D.K2SO3
7、水在下列反应中表现出还原性的是( )
A.2K+2H2O=2KOH+H2↑
B.2F2+2H2O=4HF+O2
C.2Na2O2+2H2O=4NaOH+O2↑
D.CaO+H2O=Ca(OH)2
8.在酸性溶液中能大量共存,并且溶液为无色透明的是 ( )
A.Na+、K+、Cu2+、SO42- B.NH4+、Na+、NO3-、Cl-
C.K+、Ca2+、HCO3-、Cl- D.Mg2+、Fe3+、Cl-、OH-
9.标准状况下有:①5.4mL H2O ②5.6L CH4 ③3.01×l023个H2S分子 ④19.6gH2SO4,这些物质中,含分子个数由多到少的顺序是 ( )
A.③①②④ B.③①④② C.①②③④ D.④②③①
10.阿伏加德罗常数的数值等于 ( )
A.12g碳所含的原子个数
B.22.4L CO所含的分子个数
C.1.01×l05 Pa、20℃时,0.5mol O2所含的原子个数
D.IL lmol/L Na2SO4溶液中 Na+的个数
11.下列离子方程式书写正确的是 ( )
A.金属钠投入到水中 Na+2H2O= Na+ +2OH- + H2↑
B.CaCO3与盐酸反应 CO32-+2H+==CO2↑+H2O
C.Ca(OH)2与CO2反应 Ca2+ + 2OH- + CO2 == CaCO3↓+H2O
D.实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl-==Mn2++Cl2↑+H2O
12、设NA表示阿佛加德罗常数,下列说法不正确的是( )
A.2.3g Na失去电子变成钠离子时,失去电子数为0.1NA
B.16g甲烷所含氢原子数目为4NA
C.22.4L氮气所含分子数目为NA
D.1mol H2SO4中所含氧原子数目为4NA
13、欲使每10个水分子中溶有1个Na+,则90mL水中应投入金属钠的质量为( )
A.10.5g B.11.5g C.21g D.23g
14、下列关于铯及其化合物的性质推测不正确的是( )
A.CsOH是一种可溶性强碱
B.铯与冷水反应,能发生爆炸,并产生H2
C.铯在空气中燃烧的产物只有Cs2O
D.CsHCO3不稳定,受热可发生分解反应
15.在下列反应过程中,有3mol电子转移的是 ( )
A.lmol钠与水反应
B.27g铝与足量盐酸反应
C.22.4L氧气(标准状况)与足量镁反应
D.1.5mol Na2O2与足量水反应
16.下列叙述正确的是 ( )
A.还原性:Na>K
B.热稳定性:NaHCO3>Na2CO3
C.等物质的量的NaHCO3和Na2CO3分别跟足量盐酸反应,消耗HCl的物质的量比为1:2
D.等质量的NaHCO3和Na2CO3分别跟足量盐酸反应,产生CO2的物质的量比为1:2
17.在含有KBr和NaI的混合物中通入过量Cl2充分反应后,将溶液蒸干,并将剩余残渣灼烧,最后留下的物质是 ( )
A.KCl B.KCl和NaBr C.KCl和KBr D.KCl和NaCl
18、在无土栽培中,需配制一定量含50mol NH4Cl、16mol KCl和24mol K2SO4的营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)( )
A.2、64、24 B.64、2、24
C.32、50、12 D.16、50、24
19.R2O8n-离子在一定条件下可以把Mn2+离子氧化为 MnO4-,若反应后R2O8n-变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之比为5∶2。则n的值是 ( )
A.l B.2 C.3 D.4
20、下列变化规律的叙述中,正确的是( )
A、F-、Cl-、Br -、I-的还原性逐渐减弱
B 、 NaOH、 KOH 、 RbOH的碱性逐渐减弱
C 、 Li 、 Na 、 K、 Rb、 Cs金属性逐渐减弱
D 、 HF、 HCl 、 HBr 、 HI的稳定性逐渐减弱
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、填空题:(21分)
21、(4分)选择下列物质:氯气、铜、碘化氢、水、溴化钾溶液,写出符合条件的化学方程式:
(1)一种单质氧化另一种单质: 。
(2)一种单质氧化一种化合物中的阴离子:
(3)同一种物质中两种元素间发生氧化还原反应:
(4)氯气在反应中既作氧化剂以作还原剂:
22、(4分)法医做指纹显影时,先对准指纹处喷洒AgNO3溶液,使之与人体分泌出汗水中的某一种离子结合,然后进行光照处理,就可显出指纹。请回答:
(1) 该指纹显影实验的原因是:
(2) 整个实验过程中所发生反应的化学方程式是
。
23、(8分)由A、B两种常见化合物组成的混合物,其焰色反应均呈黄色,相互转化关系如图(其他物质均已略去)
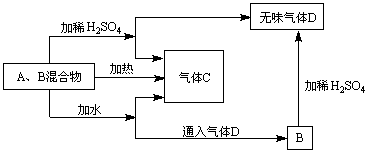
回答下列问题:
(1)(3分)化学式:A___________,B___________,C___________。
(2)(4分)B加热产生D的化学方程式__________________________;B加稀H2SO4产生D的离子方程式________________________。
(3)(1分)A、B加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为_________。(填数字)
24.(5分)相同条件下,同质量的X、Y两种气体,相对分子质量分别为A、B,则它们的体积比为 ,分子个数比为 ,密度比为 ;相同条件下的X、Y两种气体体积相同,则X:Y的质量比为 ,物质的量比为 。
三、 实验题(共16分)
25.(7分)实验室用2.0 mol/L NaCl溶液配制500mL 0.50 mol/L NaCl溶液。
(1)配制上述溶液,需要2.0 mol/L NaCl溶液 mL。
(2)配制上述溶液除需要玻璃棒、胶头滴管外,还需要的仪器有 、 、 。
(3)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①没有洗涤烧杯和玻璃棒。 。
②定容时俯视容量瓶的刻度线。 。
③如果加水超过了刻度线,取出水使液面恰好到刻度线 。
26.(9分)请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:
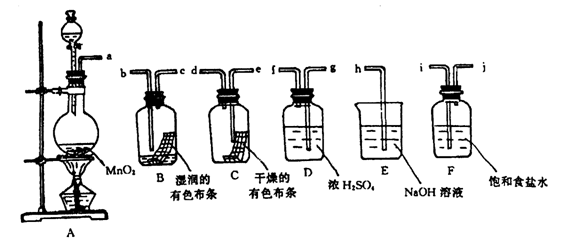
干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:
收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:
(1)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接 , 接 , 接 , 接 , 接 。
(2)烧瓶中发生反应的化学方程式是 。
(3)D装置的作用是 ,E装置的作用是 ,F装置的作用是 。
(4)C瓶中的现象是 ,B瓶中的现象是 。以上事实说明起漂白作用的物质是 。
四、计算题(共13分)
27.(4分)有某温度下22%NaNO3溶液150mL,加100g水稀释后溶质质量分数变成14%。求原溶液的物质的量浓度是多少?
28、(9分)将4.35gMnO2和50mL足量浓盐酸充分共热,收集产生的Cl2后冷却反应后的溶液,加入足量的AgNO3溶液产生71.75g白色沉淀。求:
(1) 产生Cl2在标准状况下体积是多少?
(2) 假设整个反应中HCl无挥发,则浓盐酸的物质的量浓度是多少?被氧化的HCl的物质的量是多少?
参考答案
一、选择题:
1.B 2.D 3.D 4.D 5.B 6.C 7.B 8.B 9.A 10. A 11.C 12.C 13.A 14.C 15.B 16.D 17.D 18.B19.B20.D
![]() 二、填空题:
二、填空题:
21、(1)Cu + Cl2 Cu Cl2
![]() (2)Cl2 + 2KBr = 2 KCl + Br2
(2)Cl2 + 2KBr = 2 KCl + Br2
(3)2HI H2 + I2
(4)Cl2 +H2O = HCl + HC lO
![]() 22、(1)人体汗水中有NaCl,Cl-与Ag+结合生成AgCl,光照分解生成黑色的Ag
22、(1)人体汗水中有NaCl,Cl-与Ag+结合生成AgCl,光照分解生成黑色的Ag
(2) Cl- +Ag + =AgCl 2AgCl 2Ag + Cl2↑
23、(1)A、Na2O2 B、NaHCO3 C、O2
![]()
(3)1:2(Na2O2与H2O反应生成NaOH,NaOH再吸收CO2生成Na2CO3)
24、B:A B:A A:B A:B 1:1
三、实验题:
25、(1)125.0 (2)100mL容量瓶 烧杯 量筒 (3)偏低 偏高 偏低
![]() 26、(1)i j g f e d b c h (2)MnO2 +4HCl(浓)==MnCl2+2H2O+Cl2↑
26、(1)i j g f e d b c h (2)MnO2 +4HCl(浓)==MnCl2+2H2O+Cl2↑
(3)干燥氯气 吸收多余的氯气 除去HCl气体
(4)有色布条不褪色 有色布条褪色 次氯酸(HCl)
四、计算题:
27、3.0mol/L
28、(1). 1.12L
(2)、12mol╱L, 0.1mol