卤族元素单元测试卷
原子量:H:1 O:16 Cl:35.5 ![]() :80
:80 ![]() :23
:23 ![]() :24
:24 ![]() :56 N:14
:56 N:14
一、选择题(每题有1~2个正确答案;1~10题每题2分,11~20题每题3分,共50分)
1.下列物质属于纯净物的是( )
A.碘酒 B.漂白粉 C.食盐水 D.液氯
2.将粗盐提纯制精盐的实验中,不需要的操作是( )
A.溶解 B.过滤 C.蒸馏 D.搅拌
3.下列试剂能鉴别NaCl、NaBr、NaI三瓶无色溶液的是( )
A.AgNO3和HNO3溶液 B.CaCl2溶液 C.氯水和CCl4溶液 D.FeCl2溶液
4.下列说法正确的是:①氯原子和氯离子性质一样;②+5价的氯原子只具有氧化性;③氯原子比氯离子少一个电子;④氯气具有氧化性,不具有还原性;⑤盐酸既具有氧化性、酸性,又具有还原性;⑥氯气的氧化性比盐酸的氧化性强( )
A.③⑤⑥ B.①②③ C.②③④ D.③④⑤
5.浓HCl与次氯酸钙能反应:Ca(ClO)2+4HCl(浓)=CaCl2+Cl2↑+2H2O,用贮存很久的漂白粉与浓HCl反应制得的氯气中,可能含有杂质气体是:①CO2;②HCl;③H2O(气);④O2( )
A.①②③ B.②③④ C.②③ D.①④
6.将KCl和KBr混合物13.4g溶于水配成500ml溶液,通入过量的Cl2,充分反应后,蒸干溶液得到固体物质11.175g,则配制的溶液中K+、Cl-、Br-的物质的量浓度之比为( )
A.1:2:3 B.3:2:1 C.1:3:2 D.2:3:1
7.将1.17g NaCl和1.17g NaF溶于50g H2O中,滴入过量的AgNO3溶液充分反应,得干燥的沉淀2.87g,则可以得出的结论是( )
A.AgF溶于水 B.NaCl部分参加反应 C.AgF难溶于水 D.NaF部分参加反应
8.下列说法不正确的是( )
A.液氯可以装入钢瓶中贮存 B.氯水可漂洗衣服上的墨渍
C.实验室使用的氯水要装在棕色瓶中,并且随配随用
D.实验室可利用强氧化剂如KMnO4、KClO3等与浓HCl反应的原理制Cl2
9.已知HBrO比H2CO3酸性弱,HCO3-比HBrO难电离,则下列反应可以发生的是( )
A.![]()
B.![]()
C.![]()
D.![]()
10.对于![]() 和
和![]() 两反应,下列叙述不正确的是( )
两反应,下列叙述不正确的是( )
A.Br2的氧化性强于I2氧化性 B. I-的还原性强于Br-的还原性
C.I2的氧化性强于Br2的氧化性 D. BrO3-的还原性强于IO3-还原性
11.下列物质在空气中,久置若变质,在变质过程中,既有氧化还原反应,又有非氧化还原反应发生的是( )
A. 食盐 B. 漂白粉 C. 氯水 D. 胆矾
12.现有KCl和KBr的混合物3.87g,将混合物全部溶于水并加入过量AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为( )
A.24.1% B.25.9% C.40.3% D.48.7%
13.实验室制氯气时有如下操作,操作顺序正确的是 ( )
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末 ④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收剂中
A、①②③④⑤ B、④③①②⑤ C、①③④②⑤ D、①④③②⑤
14.根据卤素性质的递变规律,推测原子半径最大的卤素-----砹(At)及其化合物不可能具有的性质是 ( )
A、砹单质为有色固体,易溶于有机溶剂; B、HAt十分稳定;
C、AgAt为有色的、难溶于水的盐; D、NaAt易溶于水。
15.湿润的淀粉碘化钾试纸接触某试剂而显蓝色,该气体中可能有( )
①Cl2 ②碘水 ③KBr ④溴化氢 ⑤HCl ⑥溴蒸气
A、①③④ B、①②⑤ C、①②⑥ D、②④⑤
16.有甲、乙、丙、丁四只集气瓶中分别装有Cl2、H2、HCl、HBr中的一种气体,甲、丁两瓶气体混和后见光会发生爆炸,甲、乙两瓶混和后,瓶壁上可见暗红色小液滴。则乙瓶中的气体是 ( )
A.HBr B.HCl C.H2 D.Cl2
17.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3—可和I—发生反应:IO3—+5I—+6H+=3I2+3H2O,根据这些反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3—,可供选用的物质有①蓝色石蕊试纸②碘化钾淀粉试纸③淀粉④食醋⑤白酒。进行上述实验时必须使用的物质是( )
A、②④ B、③⑤ C、①② D、①③
18.将37%的浓盐酸加热蒸发掉20克水,则盐酸的浓度( )
A、不变 B、增大 C、减小 D、无法确定
19.在① KCl ② NaHCO3 ③ Ca(OH)2 ④ AgNO3 ⑤ Fe粉 ⑥ KI,能使溴水褪色的有( )
A、② ③ ④ ⑤ ⑥ B、只有③ C、② ③ ④ ⑤ D、全部
20.把氟气通入NaCl溶液中可得到( )
A、氯气和氟化钠 B、氢氟酸和氧气 C、氟化氢和金属钠 D、氟化钠和氯化钠
卤族元素单元答题卷
姓名: 学号: 得分:
一、选择题:(每题有1~2个正确答案;1~10每题2分,11~20每题3分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、填空题:(共42分)
21.(11分)在分液漏斗中装入碘化钾溶液,加入适量的氯水,振荡后溶液呈现_____色,原因是_____________,反应方程式为:___________________;然后加入苯,振荡后静置,看到上层呈_______色,下层呈________色,这种分离方法称为_______。它是利用溶质在互不相溶的的溶剂_____和______里的溶解度不同,用一种溶剂________,把溶质______从另一种溶剂________的溶液里提取出来的方法。
22.(4分)碘升华实验后的烧杯粘有碘,应用 洗涤;碘中含有碘化钾,除去的方法是 ;久盛石灰水的试剂瓶上有白色固体出现,应用 洗涤;实验室用KMnO4制氧气,为除去粘附在试管壁上的MnO2,可用试剂 。
23.(17分)实验室用下列装置制取氯气,并进行后面的实验,请回答下列问题:
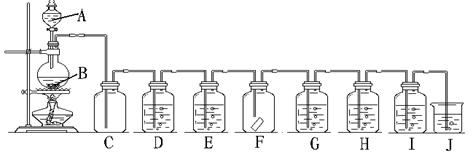
(1)A、B各放什么物质?
A: B: ,化学方程式为:
(2)储气瓶C中现象是
(3)装置D是为了除去Cl2中的氯化氢气体,D中应盛放
(4)装置E中盛放浓硫酸,其作用是
(5)装置F中放湿润的红布条,可观察到 原因是:
(6)装置G中放石蕊试液,可观察到 原因是:
(7)装置H中放溴化钠溶液,可观察到 反应的化学方程式为
(8)装置I中放KI-淀粉溶液,可观察到 原因是:
(9)装置J中放 溶液,其作用是 反应的化学方程式为
24.(6分)某固体混合物可能由KNO3、K2SO4、KI、NaCl、CuCl2、CaCl2、Na2CO3中的一种或几种组成。依次进行下列5步实验,观察到的现象记录如下:
⑴混合物加水得到无色透明溶液
⑵向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将沉淀滤出,并将滤液分成两份
⑶上述白色沉淀可完全溶于稀盐酸
⑷往一份滤液中滴加氯水并加入CCl4,振荡静置,CCl4层无色
⑸往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸
由此可推断出:混合物中一定含有 ;无法确定是否含有的是:
;为确定混合物的组成,最简单的方法是
25.(4分)用滴管将新制的饱和氯水慢慢滴入到含酚酞的NaOH稀溶液中,当滴加到最后一滴时,红色突然褪去。
(1)实验室如何保存饱和氯水?
(2)产生上述现象的原因可能有两种:(简要文字说明)①是由于氯水中的HClO将酚酞氧化而褪色;②是由于
(3)以下实验可以验证红色褪去的原因:将NaOH溶液继续滴入上述含酚酞的氯水中,若观察到 ,证明红色褪去的原因是① ;若观察到
,证明红色褪去的原因是② 。
三、计算题:
26.(8分)在250ml KI溶液中通入一定量的Cl2,再将所得溶液蒸干,并加热到质量不再减少为止,称得固体质量为23.2g,经实验分析所得固体中含碘27.37%,试计算:
(1)原KI溶液的物质的量浓度?(2)参加反应的Cl2有多少升(标况)?
卤族元素单元答题卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | AC | A | A | B | A | B | BD | CD |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | C | B | C | A | A | C | C | B |
21、棕, 有单质碘生成 2KI+Cl2=2KCl+I2 紫, 无, 萃取 水, 苯, 苯, 碘单质, 水
22、酒精,升华,盐酸,浓盐酸
23、⑴A:浓盐酸 B:MnO2 反应式略 ⑵有黄绿色气体产生 ⑶饱和食盐水
⑷干燥氯气 ⑸不变色 干燥的氯气无漂白性
⑹溶液先变红后褪色 盐酸使石蕊变红,HclO使石蕊褪色 ⑺溶液变成黄色 略
⑻溶液变成蓝色 略 ⑼NaOH 吸收尾气,防止污染空气 略
24、NaCl、Na2CO3 KNO3 焰色反应
25、⑴将氯气通入盛水的洗瓶中,将洗瓶中的另一导管通入NaOH溶液中
⑵生产的盐酸中和了NaOH溶液 ⑶无明显变化 溶液变红
26、固体中碘的质量为![]() ∴剩余KI的质量为
∴剩余KI的质量为![]() ∴生成的KCl为23.2g-8.2g=15g
∴生成的KCl为23.2g-8.2g=15g
∴2KI + Cl2 = 2KCl + I2
352 1 149
m(KI) n(Cl2) 15g
∴反应掉KI质量为![]()
∴原溶液中KI的物质的量为 ![]()
∴![]()
又∵![]() ∴标况下
∴标况下![]()
答:原KI溶液的物质的量浓度为1mol/L,参加反应的Cl2为2.24L