物质的量随堂练习
一、选择题
1.下列说法中正确的是
A.摩尔是表示物质质量的单位
B.10g氟化氢含有0.5molHF分子
C.2g氢气的体积约是22.4L
D.物质的摩尔质量等于其式量
2.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,11.2L氯气所含有的原子数目为NA
B.9g水所含有的电子数目为0.5NA
C.1mol氯分子被还原成氯离子时得到的电子数目为NA
D.0.1mol甲烷含有的质子数目为NA
3.下列物质中含原子数最多的是
A.0.5mol氯化氢 B.23gNa
C.标准状况下5.6LCO2 D.4℃5.4mL水
4.同温同压下,相同质量的下列气体所占体积最大的是
A.O2 B.CO2
C.CO D.H2
5.下列有关气体体积的叙述中,正确的是
A.一定温度和压强下,各种气态物质体积的大小由构成气体的分子大小决定。
B.一定温度和压强下,各种气态物质体积大小由构成气体的分子数决定。
C.不同的气体,若体积不同,则它们所含的分子数也不同。
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
6.下列溶液中的Cl-浓度与50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度相等的是
A.150 mL 1 mol·L-1的NaCl B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 3 mol·L-1的KCl D.75 mL 1.5 mol·L-1的CaCl2
7.使用胆矾(CuSO4•5H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中。
B.称取25g胆矾溶于水,然后将此溶液稀释至1L。
C.称取25g胆矾溶解在1L水里。
D.将16g胆矾溶于水,然后将此溶液稀释至1L。
8.容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
A.①③⑤ B.③⑤⑥
C.①②④ D.②④⑥
9.从1L 1mol/L的NaCl溶液中取出1mL,再稀释成1L,则稀释后的溶液中含NaCl的物质的量是
A.1mol B.0.1mol
C.0.01mol D.0.001mol
10.配制250mL 0.5mol/LNaOH溶液,在下列仪器中:①托盘天平②量筒③烧杯④玻璃棒⑤漏斗⑥500mL容量瓶⑦药匙⑧250mL容量瓶⑨胶头滴管⑩坩埚,需要用到的仪器有
A.①③④⑥⑨⑩ B.①④⑦⑧⑨⑩
C.①③④⑦⑧⑨ D.①②④⑤⑧⑨
11.在常温常压下,1LCO和H2的混合气体完全燃烧,共消耗相同条件下0.5LO2,在混合气体中CO与H2的体积比为
A.1:1 B.1:2
C.2:1 D.任意比
12.VL氯化镁溶液和VL氯化钠溶液混合后,Cl-物质的量浓度为0.3mol/L,原氯化镁溶液和氯化钠溶液的浓度可能是
A.均为0.3mol/L B.分别为0.1mol/L和0.4mol/L
C.分别为0.1mol/L和0.2mol/L D.均为0.6mol/L
13.在硫酸钠和硫酸铝的混合溶液中,Al3+的物质的量浓度为0.2mol/L,SO42-为0.4mol/L,溶液中Na+的物质的量浓度为
A.0.1mol/L B.0.2mol/L
C.0.3mol/L D.0.4mol/L
14.下列各组气体混合后,得到的混合气体的平均式量可能为40的是
A.CO2和CO B.SO2和CO2
C.N2和CO D.N2和O2
15.设无水硫酸铜和胆矾在某温度下的溶解度分别为S1g和S2g。在该温度下,100g水中分别溶解S1g无水硫酸铜和S2g胆矾,下列情况正确的是
A.两种溶液质量相等
B.S1>S2
C.两种溶液的物质的量浓度相等
D.两种溶液的溶质的质量分数不相等
16.某物质的相对分子质量为A,t℃时溶解度为Bg,此时饱和溶液的密度为
d ![]() ,则该饱和溶液的物质的量浓度是
,则该饱和溶液的物质的量浓度是
A.![]() mol/L B.
mol/L B.![]() mol/L
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
17.某10% NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20% NaOH溶液的物质的量浓度为
A.6.25mol/L B.12.5mol/L
C.7mol/L D.7.5mol/L
18.已知98% H2SO4的物质的量浓度为18.4mol/L,则49% H2SO4的物质的量(提示:H2SO4溶液的密度随浓度稀释而变小)
A.等于9.2mol/L B.大于9.2mol/L
C.小于9.2mol/L D.不能肯定
19.由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是
A.镁和铁 B.钠和铁
C.钠和铝 D.铁和铜
20.若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,混合气体中一氧化碳和二氧化碳的物质的量之比是
A.1:3 B.3:1
C.2:1 D.1:2
21.用同一种烧碱溶液分别中和物质的量浓度和体积都相同的盐酸、硫酸、硝酸,恰好反应完全时,消耗烧碱溶液的体积分别为aL、bL、cL,则a、b、c的数值关系是
A.a=b=c B.a=b/2=c
C.a=2b=c D.a¹b¹c
22.VmL硫酸铁溶液中含agSO42-离子,从该溶液中取出V/2 mL,并稀释至2VmL,则稀释后溶液中Fe3+的物质的量浓度约为
A.![]() mol/L
B.
mol/L
B.![]() mol/L
mol/L
C.![]() mol/L
D.
mol/L
D.![]() mol/L
mol/L
二、填空题
23.用20gNaOH配成250mL溶液,它的物质的量浓度为 。取出5mL该溶液,它的物质的量浓度为 ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ,其中含NaOH的质量为 。该100mL溶液可以跟H+浓度为0.1mol/L的硫酸溶液 mL完全中和生成正盐。
24.一定质量的某金属元素R的硝酸盐受热完全分解,反应按下式进行:
2RNO3 ==== 2R+2NO2+O2,结果得到21.6gR和6.72L气体(标准状况),R的相对原子质量是 。
25.已知某饱和溶液:(1)溶液的质量ag(2)溶剂的质量bg(3)溶液的体积VL(4)溶质的摩尔质量M g/mol(5)溶质的溶解度Sg(6)溶液的密度r g/cm3。
试从上述数据中选择适当的数据,计算该饱和溶液的物质的量浓度c mol/L,将有关数式填入下表:
| c= | c= | c= | c= |
26.36.5%的盐酸,密度是1.18g·cm-3,其物质的量浓度是__________;密度是1.84 g·cm-3、物质的量浓度为18.4mol·L-1的浓硫酸,其质量分数是______;将此浓硫酸10mL配成 2 mol·L-1的稀硫酸,则配成的稀硫酸的体积是______mL。
27.已知:Ca(ClO)2+4HCl(浓)=CaCl2+2H2O+2Cl2,若反应后产生氯气2.24L(标准状况),则消耗Ca(ClO)2的物质的量为 ,被氧化的Cl-为 mol,反应时电子转移的总数为 个。
28.实验室配制500mL0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体________g。
(2)配制时应选用________mL的容量瓶。
(3)若实验时遇到下列情况,将使溶液的浓度偏高、偏低或无影响。
A.加水定容时超过刻度线;________
B.忘记将洗涤液转入容量瓶;________
C.容量瓶洗涤后内壁有水珠而未作干燥处理;________
D.用托盘天平称量时,用生锈的砝码称量;_________
三、计算题
29. 在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1![]() )中,所得盐酸的密度为1.18 g·cm-3。求:
)中,所得盐酸的密度为1.18 g·cm-3。求:
(1)该盐酸的质量分数。
(2)取这种盐酸10mL,稀释到1.45L,所得的稀盐酸的物质的量浓度。
30.A、B两种金属元素的原子量之比是8:9,将两种金属单质按物质的量之比为3:2组成混合物1.26g,跟足量稀硫酸溶液反应,放出氢1.344L(标准状况),这两种金属单质在反应中生成的氢气的体积相等。求A和B两种金属的摩尔质量。
答案与提示:
一.选择题
1.B 2.C、D 3.A、B 4.D 5.B 6.C、D 7.B 8.A 9.D 10.C 11.D 12.B 13.B 14.A 15.C 16.B 17.A 18.C 19.D 20.B 21.B 22.D
二.填空题
23. 2mol·L-1; 2mol·L-1; 0.1mol·L-1; 0.4g; 100
24. 108
25.
![]()
26. 11.8 mol·L-1、 98%、 92
27. 0.05 mol、 0.1、 6.02×1022
28.(1)14.3 (2)500
(3)偏低、偏低、无影响、偏高
三.计算题
29.解:根据质量分数的概念:
(1)
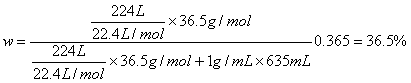
(2)稀释前后盐酸的物质的量相等,即:c1V1 = c2V2
![]()
设稀释后的盐酸浓度为c,则:
10×11.8 = 1450×c
c = 0.08 mol·L-1
30.解:根据题意,A、B都是金属,物质的量之比为3:1,而产生的氢气相等,由此可知A与酸反应生成A2+,B与酸反应生成B3+
设A、B的相对原子质量为8M、9M,物质的量为3n、2n,共生成1.344L氢气,两种金属单质在反应中生成的氢气的体积相等,每种金属生成0.672L。
生成0.672L氢气的氢原子数与金属A提供的电子数相等,则:
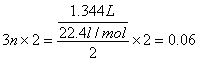 n = 0.01mol
n = 0.01mol
又据题意:3n×8M + 2n×9M = 1.26 M = 3
M(A)=3×8=24 M(B)=3×9=27
答:A和B两种金属的摩尔质量分别为24g·mol-1、27g·mol-1。