高一化学上学期期末考试题
(总分100分,考试时间90分钟)
可能用到的相对原子质量:H---1 O---16 C---12 N---14 Na---23
K---39 Br---80 I---127 Cl---35.5
第Ⅰ卷 选择题(共50分)
一、选择题(1—10小题每小题2分,11-20小题每小题3分,共50分)
![]()
![]() 1.下列反应,不属于氧化还原反应的是 ( )
1.下列反应,不属于氧化还原反应的是 ( )
A.CaCO3==== CaO+ CO2↑ B.2HClO====2HCl+ O2↑
C.2Na2O2+ 2CO2===2Na2CO3+ O2↑ D.Fe+CuSO4===FeSO4+Cu
2.碘缺乏病是目前已知的导致人类智力障碍的主要原因,为解决这一全国性问题,
我国 已经开始实施“智力工程”,最经济可行的措施是 ( )
A.食盐加碘 B.饮用水加碘 C.大量食用海带 D.注射含碘药剂
3.氧化还原反应的实质是 ( )
A.得氧和失氧 B.化合价升降
C.有无新物质生成 D.电子转移
4.下列物质长期露置于空气中都会变质,但不是发生氧化还原反应的是( )
A.Na B.NaOH C.Na2O2 D.氯水
5.检验稀碘水和稀溴水时,所用的最佳试剂是 ( )
A.淀粉溶液 B.氯水 C.NaOH溶液 D.NaBr溶液
6.在氯水中加入KI溶液,振荡,再加入CCl4振荡后静置,观察到的现象是 ( )
A.液体呈紫红色
B.液体分两层,上层无色,下层紫红色
C.液体分两层,上层紫红色,下层无色
D.液体分两层,上下均为紫红色
7.同温同压下,两种气体的体积如果不相同,其主要原因是 ( )
A.气体的分子大小不同 B.气体分子间的平均距离不同
C.气体的性质不同 D.气体的物质的量不同
8.在酸性溶液中能大量共存,并且溶液为无色透明的是 ( )
A.Na+、K+、Cu2+、SO42- B.NH4+、Na+、NO3-、Cl-
C.K+、Ca2+、HCO3-、Cl- D.Mg2+、Fe3+、Cl-、OH-
9.标准状况下有:①5.4mL H2O ②5.6L CH4 ③3.01×l023个H2S分子 ④19.6gH2SO4,
这些物质中,含分子个数由多到少的顺序是 ( )
A.③①②④ B.③①④② C.①②③④ D.④②③①
10.阿伏加德罗常数的数值等于( )
A.12g 12C所含的原子个数
B.22.4L CO所含的分子个数
C.1.01×l05 Pa、20℃时,0.5mol O2所含的原子个数
D.IL lmol/L Na2SO4溶液中 Na+的个数
11.在相同体积、相同物质的量浓度的酸中,必然相等的是( )
A.溶质的质量 B.溶质的质量分数
C.溶质的物质的量 D.氢离子的物质的量
12. 在反应8NH3+3Cl2=6NH4Cl+N2中,被氧化的氨与参加反应的氨的物质的量之比为
A. 8:3 B. 4:1 C. 3:1 D. 1:4
13.在含有KBr和NaI的混合物中通入过量Cl2充分反应后,将溶液蒸干,并将剩余残渣
灼烧,最后留下的物质是 ( )
A.KCl B.KCl和NaBr
C.KCl和KBr D.KCl和NaCl
14.某银白色金属A露置于空气中颜色逐渐变灰而生成B,B表面逐渐形成液态的
C,最后C又变成白色粉末状D。取D在无色火焰上灼烧,有黄色火焰。下列
各组物质中,按A、B、C、D顺序排列的是 ( )
A.K、K2O、K2CO3、KHCO3 B.Na、Na2O2、NaOH、Na2CO3
C.K、K2O、KOH、K2CO3 D.Na、Na2O、NaOH、Na2CO3
15.下列离子方程式书写正确的是 ( )
A.金属钠投入到水中 Na+2H2O= Na+ +2OH- + H2↑
B.CaCO3与盐酸反应 CO32-+2H+==CO2↑+H2O
C.Ca(OH)2与CO2反应 Ca2+ + 2OH- + CO2 == CaCO3↓+H2O
D.实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl-==Mn2++Cl2↑+H2O
16.某碱金属0.195g与足量的水反应时,生成0.0050g氢气,这种金属是( )
A.锂 B.钠 C.钾 D.铷
17.1.0gH2在空气中完全燃烧,需要标况下的空气体积为 ( )
A.5.6 L B.11.2L C.26.7L D.1L
18.R2O8n-离子在一定条件下可以把Mn2+离子氧化为 MnO4-,若反应后R2O8n-变为RO42-
离子。又知反应中氧化剂与还原剂的物质的量之比为5∶2。则n的值是( )
A.l B.2 C.3 D.4
19.将一定量的NaHCO3和Na2CO3的混合物加热到不再放出气体时,收集到CO2 aL,
冷却后向残余物中加入足量盐酸又收集到CO2 2aL(体积均在标准状况测定)。
则混合物中Na2CO3和NaHCO3的物质的量之比为 ( )
A.1∶1 B.1∶2 C.1∶3 D.1∶4
20.由CO和H2组成的混合气体3.6g在足量的O2中充分燃烧后,立即通入足量的Na2O2 固体中,固体的质量增加 ( )
A.l.8g B.3.6g C.7.2g D.不可求
第Ⅱ卷 非选择题(共50分)
二、境空题(共22分)
21.(9分)新制的氯水显 色,说明氯水中有 分子存在。向氯水中滴入几滴AgNO3溶液,立即有 生成,说明氯水中有 存在。蓝色石蕊试纸遇到氯水后,首先变红,但很快又褪色,这是因为 。氯水经光照后,黄绿色消失,并放出无色的 气,该反应的化学方程式是 。
22.(2分)4.6g Na放在 g水中,才能使每10个水分子中溶有一个Na+。
23.(6分)与16g氧气所含的分子数相同的氨气是 g;与16g氧气所含的原子总数相同的氨气是 g;相同条件下,在5.6g氮气中添加 g氨气,所组成的混合气体的体积与16g氧气所占的体积相等。
24.(5分)用“双线桥法”分析下列氧化还原反应电子转移情况,并指出氧化剂、还原剂、氧化产物、还原产物。
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+4H2O
MnCl2+Cl2↑+4H2O
氧化剂 ,还原剂 ,氧化产物 ,还原产物 。
三、实验题(共16分)
25.(7分)实验室用2.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
(1)配制上述溶液,需要2.0 mol/L NaCl溶液 mL。
(2)配制上述溶液除需要玻璃棒、胶头滴管外,还需要的仪器有 、 、 。
(3)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①没有洗涤烧杯和玻璃棒。 。
②定容时俯视容量瓶的刻度线。 。
③如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
26.(9分)请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:
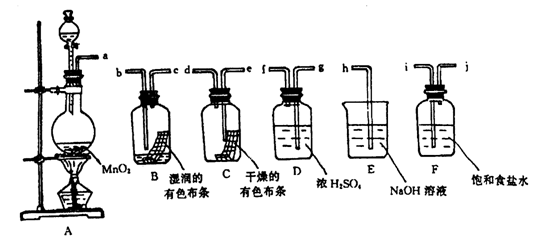
(1)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接 ,
接 , 接 , 接 , 接 。
(2)烧瓶中发生反应的化学方程式是 。
(3)D装置的作用是 ,E装置的作用是 ,
F装置的作用是 。
(4)C瓶中的现象是 ,B瓶中的现象是 。以上事
实说明起漂白作用的物质是 。
四、计算题(共12分)
27.(4分)配制250mL0.2mol/L的盐酸,需密度为1.19g/cm3,溶质质量分数为37.5%的浓盐酸多少毫升?
28.(8分)将36mlKBr和KI的混合溶液分为二等份。向其中一份通如足量Cl2,完全反应后蒸发溶液至干,灼烧所得物质,得到6.1g固体残留物。测得另一份混合溶液中
I —的浓度为0.86mol/L。计算:
(1)固体残留物中含有什么物质?
(2)原溶液中含有KBr的质量是多少?
(3)反应完全时消耗Cl2的体积(标准状况)是多少?