高一年级第二学期期中考试化学卷
化 学 试 卷
(时间:90min 分值:100分)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 S 32
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意。)
1、 我国自己设计安装的秦山核电站所用的燃料铀—235的氧化物![]() (氧的质量
(氧的质量
分数为16),1mol此氧化物中所含的中子数是阿伏加德罗常数的
A、143倍 B、159倍 C、267倍 D、151倍
2、 已知硼化物BxHyz—,与B10C2H12的电子总数相同,则BxHyz—的正确表达式为
A、B9H152— B、B10H142— C、B11H132— D、B12H122—
3、 两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表中的前18号元素中,满足上述关系的元素共有
A、1对 B、2对 C、3对 D、4对
4、 已知短周期元素的离子aA2+、bB+、cC3—、dD—都具有相同的电子层结构,则下列叙述正确的是
A、原子半径A>B>D>C B、原子序数d>c>b>a
C、离子半径C>D>B>A D、单质的还原性A>B>D>C
5、 下列描述的元素中,一定属于主族元素的是
A、元素的最外层电子个数为2 B、元素的最外层电子个数为6
C、位于元素周期表中IIA族右边的元素 D、阴离子RO4—中的R元素
6、甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A、x+4 B、x+8 C、x+10 D、x+18
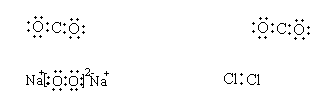 7、下列物质的电子式书写正确的是
7、下列物质的电子式书写正确的是
A、四氯化碳 B、二氧化碳
C、过氧化钠 D、氯气
 8、A、B、C均为短周期元素,它们在周期表中的位置如左图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数之和的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是
8、A、B、C均为短周期元素,它们在周期表中的位置如左图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数之和的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是
A、C、Al、P B、N、Si、S C、O、P、Cl D、F、S、Ar
9、关于化学键的下列各种叙述中,正确的是
A、 在离子化合物里,只存在离子键
B、共价化合物里,一定不存在离子键
C、非金属元素之间只能形成共价键
D、由不同种元素组成的多原子分子里,一定只存在极性键
10、最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种物质的叙述中正确的是
A、是混合物 B、是化合物 C、不含极性键 D、含有离子键
11、随着核电荷数的递增,下列关于氧族元素(Po除外)性质叙述中,错误的是
A、固态单质的导电性逐渐增强 B、元素的非金属性逐渐增强
C、氢化物的稳定性逐渐减弱 D、单质的熔、沸点逐渐升高
12、下列实验中:①使澄清石灰水变浑浊;②使湿润的蓝色石蕊试纸变红;③使品红溶
液褪色;④通入足量的NaOH溶液中,再滴加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸;⑤通入溴水中能使溴水褪色,且滴加Ba(NO3)2溶液有白色沉淀产生。其中能证明有SO2存在的是
A、都能证明 B、都不能证明 C、③④⑤能证明 D、只有⑤能证明
13、在一定体积的18mol/L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,
则浓硫酸的实际体积
A、等于50mL B、大于50 mL C、等于100 mL D、大于100 mL 14、绿色化学是日渐为人们所熟悉的社会概念,绿色食品的基本标准是①香甜可口;②无污染;③表面呈绿色;④无化学添加剂;⑤有营养价值。
A、①②③⑤ B、①③④⑤ C、②④⑤ D、①②③④
15、由NaHS、MgSO4和NaHSO3三种物质组成的某固体混合物中硫元素的质量分数为a%,则该混合物中氧元素的质量分数为
A、a% B、2a% C、1-1.75a% D、1-0.75a%
16、下列溶液中,反应后溶液中H+的物质的量浓度明显增大的是:
A、将CO2通入饱和CaCl2溶液中 B、将H2S通入饱和硫酸亚铁溶液中
C、将H2S通入饱和SO2溶液中 D、将SO2通入氯水中
17、下列不能说明氧的非金属性比硫强的事实是:
A、氧气和氢气化合比硫和氢气化合容易
B、水在常温下是液体,而硫化氢是气体
C、硫化氢的水溶液露置于空气中会变质
D、硫在氧化物中硫显正价而氧显负价
18、下列离子能在溶液中大量共存的是
A、K+、H+、NO3—、SO42— B、Na+、H+、CO32—、SO42—
C、K+、Ba2+、Cl—、SO42— D、Fe3+、Na+、Cl—、OH—
请将选择题答案填入下表中:
班级 姓名 学号
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、(本题包括2小题,共17分)
19、(7分)A、B、C、D都是短周期元素。A元素的原子核外有两个电子层,最外层已达到饱和。B元素位于A元素的下一周期,最外层电子数是A元素最外层电子数的1/2。C元素的离子带有两个单位正电荷,它的核外电子排布与A元素原子相同。D元素与C元素属同一周期,D元素原子的最外层电子数比A的最外层电子数少1。
根据上述事实判断:(填元素符号)A ,B ,C ,D 。
B元素位于 周期 族,它的最高价氧化物的化学式是 。
20、(10分)a、b、c、d、e、f、g、h为八种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 单核 |
| 带电荷数 单位(电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 | 3+ |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:
(1)a微粒的结构示意简图 ;
(2)b与e相应元素的最高价氧化物对应水化物中,碱性较强的为 (用化学式表示)。c微粒与f反应的离子方程式为 。
(3)向h中逐滴加入c的离子方程式为 ;
。
三、(本题包括2题,共16分)
21、(8分)A、B、C、D四种可溶性盐,它们的阳离子可能分别是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能分别是NO3-、SO42-、Cl-、SO32-的某一种。
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,B盐溶液有沉淀产生,D盐溶液有刺激性气体逸出。根据(1)、(2)实验事实可推断它们的化学式为:A 、B 、C 、D 。
22、(8分)已知某氯化钾样品中含有K2SO4杂质,为了除去K2SO4杂质,设计了如下实验步骤:
(1) 将KCl样品溶于适量蒸馏水,配成溶液;
(2) 向溶液中滴入K2CO3溶液,边滴加边振荡至不再产生白色沉淀;
(3) 向溶液中滴入BaCl2溶液,边滴加边振荡至不再产生白色沉淀;
(4) 过滤,将白色沉淀滤出;
(5) 向滤液中滴加稀HCl,边滴加边振荡至不再产生气体;
(6) 将滤液蒸干,得到晶体。
正确的实验操作顺序为 ;
有关的离子方程式为: , 、
。
四、(本题包括2小题,共13分)
23、(3)某元素R的最高价氧化物化学式为RO2,且R的气态氢化物中氢的质量分数为25%,此元素是 (填元素符号)。
24、(10分)使一定质量的Zn与100mL18.5mol/L的浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L。将反应后溶液稀释至1L,测得溶液中c(H+)=0.1mol/L。求气体A中各组分的体积比。
参考答案:
一、选择题(每题3分,共54分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | D | D | C | B | A | C | C | B | B | B | D | D | C | C | D | B | A |
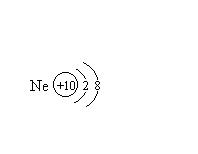
二、填空题(19题每空1分,其它每空2分)
19、(每空1分)A:Ne;B:Si;C:Mg;D:Cl 第三 IVA SiO2
20、(1) (2)NaOH H3O++OH—=2H2O
(3)Al3++3OH—=Al(OH)3↓ Al(OH)3 +OH—=AlO2—+2H2O
三、(每空2分)
21、A:BaCl2;B:AgNO3;C:CuSO4;D:Na2SO3。
22、1、3、2、4、5、6 Ba2++SO42—=BaSO4↓ Ba2++CO32—= BaCO3↓
CO32—+H+=H2O+CO2↑
四、(23题3分,24题10分)
23、C
24、V(SO2)∶V(H2)=1∶4