高一化学期末测试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Ca 40 Zn 65
一、选择题(每题只有一个选项符合题意。共5小题,每小题2分,共10分)
1. 二十世纪九十年代初,国际上提出了“预防污染”这一概念。能造成大气污染的主要物质是( )
A.二氧化碳、氮气、氯气、烟雾
B.水蒸气、氯化氢、氨气、烟尘
C.二氧化硫、氮氧化物、一氧化碳、烟尘
D.氯化氢、二氧化硫、粉尘、氢气
2. O3和O2是( )
A.同一种物质 B.氧元素的同素异形体
C.同位素 D.不同的化合物
3. 人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的这种同位素应表示为( )
![]() A
A ![]() He
B
He
B ![]() He
C
He
C ![]() He
D
He
D ![]() He
He
4. 下列各组指定原子序数的元素中,能形成XY2型化合物的是( )
A.3和9 B.10和4 C.7和12 D.6和8
5. 下列物质在氧化还原反应中,只具有还原性的是( )
A.Na B.Cl2 C.H2SO4 D.SO2
一、选择题(每题只有一个选项符合题意。共15小题,每小题3分,共45分)
6. 下列几种酸中,酸性最弱的是( ) ( )
A. HClO4 B. HI C. H3PO4 D. H2SO4
7. 陶瓷已广泛应用于生产和生活中,下列不属于陶瓷制品的是( )
A.电器中的绝缘瓷管 B.实验室用的药匙
C.实验室用的坩埚 D.建筑装饰上用的墙砖
8. 下列变化属于化学变化的是( )
A.红磷转变为白磷; B.三氧化硫从气态转变为固态;
C.将CO2制成干冰; D.在盛有红墨水的烧杯中加入活性炭,红色变浅。
9. 下列物质能使品红溶液褪色的是( )
①Cl2 ②Na2O2 ③Ca(ClO)2 ④活性炭 ⑤SO2
A.仅②③④⑤ B.仅①②③ C.仅①④⑤ D.全都可以
10. 下列试剂保存方法不正确的是( )
A、NaOH溶液保存于带橡胶塞的试剂瓶中 B、液溴保存于有水作液封的棕色试剂瓶中
C、金属钠保存于用煤油作液封的试剂瓶中 D、过氧化钠粉末可以保存于敞口容器中
11. 根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A. K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B. L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C. L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D. M层电子为奇数的所有主族 元素所在族的序数与该元素原子的M层电子数相等
12. 在强酸性溶液中能大量共存且溶液为无色透明的离子组是( )
A. Na+、K+、NO3-、HCO3- B. K+、SO42-、MnO4-、NO3-
C. K+、HS-、Na+、NO3- D. Mg2+、SO42-、NH4+、Cl-
13. 向50mL 18mol·L-1的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45mol B. 等于0.45mol
C. 在0.45mol与0.90mol之间 D. 大于0.90mol
14. 将8g硫在16g氧气中充分燃烧后,所得气体在标准状况下的总体积为( )
| |
15. 已知短周期元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A D. 单质的还原性 A>B>D>C
16. 下列现象与浓H2SO4的性质(括号内为性质)不对应的是( )
A. 浓H2SO4滴入蔗糖,蔗糖炭化变黑(脱水性)
B. 将棉花放入浓H2SO4中,棉花逐渐变黑(吸水性)
C. 浓H2SO4露置在空气中,质量会增加(吸水性)
D.木炭放入浓H2SO4中加热生成CO2、H2O和SO2(氧化性)
17. 下列各组物质中,化学键类型完全相同的是
A. HCl和NaCl B. H2SO4和(NH4)2SO4
C. Na2O2和H2O D. CO2和HBr
18. 下列说法中不正确的是( )
①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素;
⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数,就是其质量数
A. ①②④⑤ B. ③④⑤⑥ C. ②③⑤⑥ D. ①②⑤⑥
19. 新型无机非金属材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,这些物质需要在高温条件下才能合成,在合成工艺中必须注意( )
A. 通入充足的氧气 B. 避免与氧气接触
C. 通入少量的氧气 D. 不必考虑是否有氧气的存在
20. 1999年是人工合成元素的丰收年,美国等国的科学家先后合成了质子数为114、116、118等的元素。根据原子结构理论和元素周期律知识,下列关于114号元素的说法中不正确的是( )
A、该元素在第七周期第ⅣA族 B、该元素形成的单质能与盐酸反应
C、该元素是非金属元素 D、该元素原子半径比碳原子大
二、填空题(本题共19分)
21. (3分)请写出4种性质不同的化合物分子,这些分子都各具有10个电子,它们的分子式是 ,其热稳定性由强到弱顺序为 。
22. (4分)下列物质中,仅含有离子键的是(填序号,下同)____ ____,含有极性键和非极性键的物质是______ __,既含有离子键又含有极性键的是_____ ___,既含有离子键又含有非极性键的是_____ ___。
①HCl、 ②H2O2、 ③NH4Cl、 ④Na2O2、 ⑤KOH、 ⑥K2O、 ⑦CCl4
23. (3分) 工业上从硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸。加入盐酸共热,硒酸被转化为亚硒酸,同时生成氯气。再将二氧化硫通入亚硒酸的溶液中,单质硒即析出。完成有关反应方程式:
(1)盐酸与硒酸反应____________________________________________________。
(2)二氧化硫与亚硒酸反应____________________________________________________。
24. (4分) 在下列物质的转化关系中,A是一种固体单质,E是一种白色沉淀,据此填写
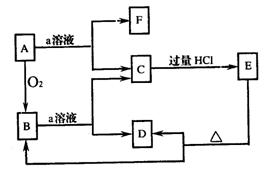
(1)B的化学式是 。
(2)B和a溶液反应的离子方程式是 。
(3)A和a溶液反应的离子方程式是 。
25. (5分) A、B、C、D是同一周期的四种元素,A、B、C的原子序数依次相差1,A元素的单质化学性质很活泼,A元素的原子在本周期中原子半径最大,B元素的氧化物2g恰好和100mL 0.5mol·L-1的稀硫酸完全反应,B元素的单质和D元素的单质反应生成化合物BD2,根据以上事实回答;
(1)A的焰色反应呈 色。
(2)C原子的原子结构示意图为 。
(3)用电子式表示BD2的结构 。
(4)若向C的最高价氧化物的水化物中加入A的最高价氧化物的水化物,则反应的离子方程式为 。
三、实验题(本题共14分)
26. (8分) 写出除去下列物质中少量杂质的方法及有关化学方程式或离子方程式。
(1)除去硫酸钾溶液中的碳酸钾。方法是 。
离子方程式是 。
(2)除去CO2中的SO2。方法是 。
化学方程式是 。
(3)除去Fe2O3中的Al2O3。方法是 。
离子方程式是 。
27. (6分) 为说明浓硫酸跟木炭反应得到的气体是二氧化碳和二氧化硫的混合气体,需分别对这两种气体进行检验。现有下图所示的仪器装置:
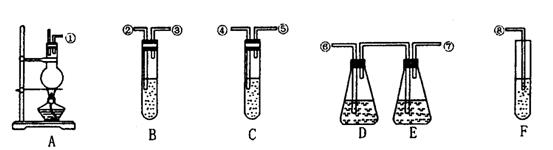
A为木炭与浓硫酸的反应装置:B、C中均盛有稀品红溶液;D、E中均盛有较浓的酸性高锰酸钾溶液;F中盛有0.2mol·L-1的氢氧化钡溶液。试回答:
(1)各导管连接顺序,按气流方向由左到右(填编号)是①接 ,
接 , 接 , 接 。
(2)确认有CO2的装置是(填编号字母) ,现象是
。
(3)B、C两装置的作用分别是 。
五、计算题(本题共12分)
28. (6分) 使一定质量的Zn与100mL18.5mol/L的浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L。计算:
(1)参加反应的Zn的质量是______________g。
(2)求气体A中各组分的体积比。
29. (6分) 将26g碳酸钙和二氧化硅的混合物高温灼烧至质量不再减少为止,冷却后,称得残留物的质量为17.2g。
(1)原混合物中碳酸钙和二氧化硅的质量分别为 g和 g。
(2)生成物的成分为 。(填化学式)
参考答案:
1.C 目前导致空气污染的主要成分是二氧化硫、氮氧化物、一氧化碳、烟尘等。
2.B O3和O2是由氧元素组成的两种不同单质,故为同素异形体;而同位素则是同种元素的不同原子的互称。
3.A 主要考查原子组成符号的表示方法,同时提醒学生必须记住短周期元素的核电荷数(即质子数)。
4.D 本题若能将原子序数与元素对号入座,或由原子序数推断出最外层电子数,问题将迎刃而解。
5.A 本题是典型的根据物质所含元素化合价判断物质氧化还原性的题目。所含元素化合价处于最低价的物质,只具有还原性,所含元素化合价处于最高价的物质,只具有氧化性,所含元素化合价处于中间价的物质,既具有氧化性又具有还原性。Na处于最低价,只有还原性;Cl2 和SO2中的氯元素和硫元素都处于中间价,故既有氧化性又有还原性;H2SO4中的硫元素处于最高价,只有氧化性。故选择A
6.C 本题既考查了同周期元素从左到右最高价氧化物水化物酸性的变化规律,又考查了氢卤酸的酸性变化规律。同周期元素从左到右最高价氧化物水化物酸性增强,磷酸的酸性最弱。从氟到碘氢卤酸的酸性增强,说明氢碘酸的酸性比盐酸酸性强。故选择C。
7.B 本题是实际应用题,实验室的药匙是用塑料或牛角做成的。
8.A 白磷和红磷是磷元素的两种不同单质,它们之间的转变是化学变化。而B、C两选项只是物质的状态的变化,属于物理变化;活性炭是依靠其吸咐性而使红色变浅的,也是物理变化。9.D 使有色溶液褪色的原理有化学变化和物理变化两种形式,前者发生了化学反应,又包括两种类型:强氧化性的物质一般都可使有色物质氧化为无色物质,如次氯酸、过氧化钠、过氧化氢、臭氧、浓硝酸等,它们可使大多数有机色素褪色,包括酸碱指示剂,且为永久的漂白;另一种是二氧化硫,只能与部分有机色素化合成不稳定的无色物质,会慢慢分解恢复原来的颜色,不能对指示剂进行漂白。而像活性炭、木炭、硅胶等的漂白则是运用它们表面积大,具有强吸附性而将有机色素吸附在其表面的,一般加热后又将恢复原来的颜色。
10.D 氢氧化钠能与玻璃的主要成分二氧化硅发生反应,生成粘性的硅酸钠而将瓶口和瓶盖粘在一起无法打开,故用橡胶塞;液溴易挥发,且密度比水大,加水液封可降低其挥发;金属钠易与水和氧气反应,应保存在煤油中;过氧化可与空气中的二氧化碳和水蒸气反应,必须密封保存。
11.C K层最多只能容纳2个电子,为奇数时即为1个电子,是氢元素,一定在第一主族;L层最多只能容纳8个电子,而为奇数时一定是最外层,其电子数一定等于族序数;当L层电子数是偶数时,可以是8个电子且不一定是最外层,而主族序数等于其最外层电子数,故是错误的。M层电子数为奇数的主族元素其M层一定是最外层,所以其M层电子数一定等于主族序数。
12.D A选项中的组内离子可以共存,但HCO3-不能存在于酸性溶液中;B选项中的MnO4-是有颜色的,不符合题意;C选项中的HS-不能存在于酸性溶液中;只有D选项中的离子全部符合题中的条件。
13.C 只有浓硫酸才能在加热时与铜片发生反应,所以当浓硫酸与足量铜片反应在其变为稀硫酸时,反应将停止,一定量的硫酸不能完全参加反应,故被还原的硫酸的量也将减少。
14.B 由S+O2=SO2知,反应前后气体体积相等,故反应前氧气在标准状况下的体积即为反应后气体的体积,。
15.C 由具有相同电子层结构的离子,核电荷数越大,半径越小的规律,很容易得出正确答案。16.B 仍是浓硫酸的脱水性。
17.D 一般地,活泼的非金属元素和活泼的金属元素原子之间形成的化学键是离子键,而非金属元素原子之间形成的化学键一般是共价键,但铵盐属于离子化合物,它既有离子键也有共价键。
18.D 本题主要考查概念的辨析。粒子包括原子、分子、离子等等;而原子才有质量数,元素则没有;同位素的化学性质几乎完全相同。
19.B 合成题给各种非金属材料的原料在高温下均能与氧气发生反应。
20.C 首先由原子序数可推得114号元素位于周期表中的第七周期第四主族。进而根据同主族元素的性质变化规律判断出本题的正确答案。
21.CH4、NH3、H2O、HF; HF、H2O、NH3、CH4。
22.⑥;②;③⑤;④。
23.(1)H2SeO4+2HCl= H2SeO3+Cl2+H2O (2)2SO2+H2SeO3 +H2O=Se+2H2SO4
24.(1)SiO2 (2) SiO2+2OH-=SiO32-+H2O (3)Si+2OH-+H2O =SiO32- +2H2↑
25.(1)黄 (2)铝原子结构示意图(略) (3)MgCl2的电子式(略) (4)Al(OH)3+OH-=AlO2-+2H2O
26.(1)加入适量硫酸溶液;CO32-+2H+=CO2↑+H2O (2)通过盛有饱和碳酸氢钠溶液的洗气瓶;2NaHCO3 +SO2=Na2SO3+2 CO2↑+H2O (3)加入过量的氢氧化钠溶液后过滤;Al2O3+2OH-= AlO2-+H2O
27.(1)②③⑥⑦④⑤⑧ (2)F;有白色沉淀生成。 (3)分别证明有SO2气体生成和SO2气体已经被除尽。
28.(1) (1)97.5g 。 (2) SO2与H2的体积比为1∶4。 解析:(1)浓硫酸与锌发生下列反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;但随着反应的进行,浓硫酸将变为稀硫酸,此时与锌又发生下列反应:Zn+2H2SO4(稀)=ZnSO4+H2↑。所以生成的气体是SO2和H2的混合气体。由上述两个反应方程式知,参加反应的锌的物质的量等于生成的混合气体的物质的量,即为![]() =1.5mol,所以参加反应的锌的质量是:1.5mol ×65g·mol-1=97.5g。(2)参加反应的硫酸的物质的量是:0.1L×18.5mol·L-1-0.1mol·L-1×1/2×1L=1.8mol,其中生成硫酸锌的硫酸是1.5mol,则被还原为的硫酸是0.3mol,即生成SO2气体0.3mol,所以混合气体中有H21.2mol,则SO2与H2的体积比为1∶4。
=1.5mol,所以参加反应的锌的质量是:1.5mol ×65g·mol-1=97.5g。(2)参加反应的硫酸的物质的量是:0.1L×18.5mol·L-1-0.1mol·L-1×1/2×1L=1.8mol,其中生成硫酸锌的硫酸是1.5mol,则被还原为的硫酸是0.3mol,即生成SO2气体0.3mol,所以混合气体中有H21.2mol,则SO2与H2的体积比为1∶4。
29. (1)20;6。 (2)CaSiO3和CaO。 解析:本题一定发生反应CaCO3+SiO2=CaSiO3+CO2↑;可能发生反应CaCO3 =CaO+CO2↑。固体物质减少的质量即为生成的CO2气体的质量,由此可计算出CaCO3的质量是20g,则SiO2的质量是6g,并由第一个反应方程式知CaCO3过量,所以最后的固体物质是CaSiO3和CaO的混合物。