第一学期期末调研测试试题
高 一 化 学(B)
| 卷别 | 第Ⅰ卷 | 第Ⅱ卷 | 总分 | 积分人 | ||
| 题号 | 一、二(1-20) | 三(21-24) | 四(25-26) | 五(27-28) | ||
| 得分 | ||||||
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至3页(第1至20题),第Ⅱ卷4至6页(第21至28题)共100分,考试时间100分钟。
第Ⅰ卷(选择题 共40分)
注意事项:
1、 答第Ⅰ卷前,考生务必将本人的学校、班级、姓名、学号、考试号填在第Ⅱ卷的密封线内。
2、 将第Ⅰ卷上每小题所选答案前的字母标号填写在第Ⅱ卷卷首相应的答题栏内。在第Ⅰ卷上答题无效。
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23 K:39 Mn:55 Ag:108 Ba:137
一、 选择题(每小题只有一个选项符合题意, 每小题2分,共20分)
1.新材料是高科技的突破口,化学在研制新材料方面发挥了巨大作用。比如,通过化学方法研制出了信息材料、结构材料等。下列不属于信息材料的是
A.半导体 B.光导纤维 C.液晶高分子 D.水泥
2.强光照射下,下列物质不会发生化学反应的是
A.氢气和氯气的混合物 B.氯水
C.氢气和氧气的混合物 D.溴化银
3.有关能源的下列说法错误的是
A.煤、石油、天然气都是化石燃料 B.化石能源是非再生能源
C.氢能是可再生能源 D.水能是可再生的新能源
4.下列因素对气体体积的大小无影响的是
A.气体分子的直径 B.气体分子的数目
C.气体的温度 D.气体的压强
5.下列微粒中,不具有氧化性的是
A.O22― B.O2― C.H+ D.S
6.下列各组离子可以在水溶液中大量共存的是
A.HCO3-、Ca2+、OH-、Na+ B.K+、H+、Cl-、ClO-
C.SO42-、OH-、NH4+、H+ D.Na+、HCO3-、Ca2+、Br-
7.碘被称为“智力元素”,防止碘缺乏病,以食用含碘食盐(含KIO3)为最方便。已知在酸性溶液中,可发生反应: IO3― + 5I― + 6H+ == 3I2 + 3H2O
现有下列物质:①pH试纸;②稀H2SO4;③淀粉–碘化钾溶液;④淀粉溶液;⑤硫酸钠溶液。其中,可通过上述反应来检验食盐中含有KIO3的是
A.①③ B. ②④ C. ②③ D. ①④
![]() 8.在2H2S + SO2 3S↓ + 2H2O
的反应中,氧化剂与还原剂的物质的量之比为
8.在2H2S + SO2 3S↓ + 2H2O
的反应中,氧化剂与还原剂的物质的量之比为
A.2:1 B.1:2 C.3:2 D.1:1
9.下列溶液中的氯离子浓度与100mL 0.5 mol•L―1氯化铝溶液中的氯离子浓度相等的是
A.50mL 1.5 mol•L―1的KCl溶液 B.50mL 0.5 mol•L―1的FeCl2溶液
C.100mL 1 mol•L―1的MgCl2溶液 D.450mL 0.5 mol•L―1的NaCl溶液
10.甲、乙、丙、丁四个集气瓶中分别装有Cl2、H2、HCl、HBr中的任意一种气体。若将甲和丁两瓶气体混合,见光发生爆炸;若将甲和乙两瓶气体混合,可见瓶壁上出现深红棕色的小液滴。则气体乙是
A.H2 B.Cl2 C.HCl D.HBr
二、选择题(每小题有1~2个选项符合题意,每小题2分,共20分)
11.设N0表示阿伏加德罗常数的数值,下列说法正确的是
A.11.2 L O2中含氧原子数为N0 B.18 g 水所含电子数为10N0
C.2.3 g 金属钠变为钠离子失去的电子数为N0
D.1 mol Na2O2与H2O充分反应转移电子数为N0
12.下列物质的性质比较中,错误的是
A.稳定性HF>HCl>HBr>HI B.密度Cs<Rb<K<Na
C.还原性F->Cl->Br->I- D.离子半径Li+<Na+<K+<Rb+
13.能正确表示下列反应的离子方程式是
A. 钠跟水反应: 2Na+2H2O==2Na++2OH-+H2↑
B.氯气跟水反应:Cl2+H2O==2H++Cl-+ClO-
C.氢氧化钡和稀硫酸反应:Ba2++ SO42-==BaSO4 ↓
D.碳酸氢钠溶液中加入足量Ca(OH)2溶液:HCO3-+Ca2++OH—==CaCO3↓+H2O
14.1L的H2SO4溶液中,含H+ 的质量是0.4 g,,则溶液中SO42一的物质的量浓度为
A.0.1mol·L一1 B.0.2mol·L一1
C.0.15mol·L一1 D.0.4mol·L一1
15.由CH4和O2组成的混合气体,在标准状况下的密度为1 g •L―1,则该混合气体中CH4和O2的体积比为
A.3:2 B.2:1 C.2:3 D.1:2
16.下列说法正确的是
A.某溶液中滴入AgNO3溶液,生成白色沉淀,该溶液中可能含Cl—
B.实验已经证明,氯水是可以导电的,所以氯水是电解质
C.某溶液与淀粉碘化钾溶液反应后出现蓝色,则证明该溶液是氯水或碘水
D.氟气跟氯化钠水溶液反应,有HF和O2生成
17.下列物质中,不能由金属单质与氯气化合得到的是
A.CuCl2 B.MgCl2 C.NaCl D.FeCl2
18. 下列物质久置空气中,因发生氧化还原反应而变质的是
A、Na B、NaOH C、Na2O2 D、NaCl
19.根据反应式:2Fe3++2I-=2Fe2++I2 , Br2+2Fe2+=2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是:
A.Br-、Fe2+、Cl- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
20.在标准状况下,将VL气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为
A.![]()
![]() B.
B.![]()
C.![]() D.
D.![]()
第Ⅱ卷(非选择题 共 60 分)
| 得分 | 评卷人 |
第Ⅰ卷答题栏
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | ||||||||||
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 |
| 得分 | 评卷人 |
三、填空题(共29分)
21. (5分)请用下列物质的序号填空:
A.Na2O2 B.Na2CO3 C.NaHCO3 D.K-Na合金
E.Na F.Ca(ClO)2 G.CaCO3 H.NaCl
(1)可用于潜艇中供氧剂的是 ;
(2)可用于消毒饮用水的是 ;
(3)可用作原子反应堆的导热剂的是 ;
(4) 可用作制取发酵粉或用于治疗胃酸过多的药物的是 ;
(5) 广泛用于玻璃、制皂、造纸、纺织工业上的是 。
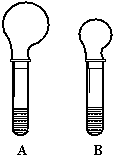 22.(8分)(1)右图是等质量的Na2CO3、
NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较少的试管中加入的固体试剂是_________,当反应结束时,A、B两试管中消耗盐酸的物质的量之比为________________。
22.(8分)(1)右图是等质量的Na2CO3、
NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较少的试管中加入的固体试剂是_________,当反应结束时,A、B两试管中消耗盐酸的物质的量之比为________________。
(2)实验过程中我们还能感受到Na2CO3与盐酸反应时是放
热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B
两试管中,反应体系的能量变化的总趋势分别对应于
A—( ),B—( )。(在括号内填写a或b)
23.(8分)在标准状况下,有:①4.8g CH4 ; ②11.2L HCl;③2.408×1023个H2S气体分子;
④ 0.2mol NH3。对于这四种气体而言,请用序号比较下列各项的大小:
(1)物质的量由多到少的顺序为: ;
(2)质量由大到小的顺序为:_________________________________;
(3)体积由大到小的顺序为:_________________________________;
(4)密度由大到小的顺序为:_________________________________。
|
![]()
|
|
![]()
![]() 无色无味气体C
白色沉淀D
无色无味气体C
白色沉淀D
|
|
![]()
![]() E的水溶液 A的水溶液
E的水溶液 A的水溶液
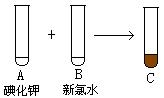
⑴按以上的反应图式,写出它们的化学式
A ,B ,C ,D ,E 。
⑵写出①、②、③三个反应的离子方程式:
①_______________ ;
②___________________ ;
③____________________ 。
| 得分 | 评卷人 |
四.实验题(共17分)
25.(7分)根据图①、图②回答下列问题:
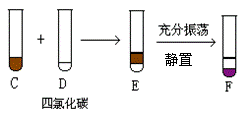
图① 图②
⑴A和B反应的化学方程式为 。
⑵四氯化碳是_____色、比水_______的液体。
⑶F中下层液体的颜色为_____色,上层液体中溶质的主要成分为______________。
⑷分离F中的两种液体通常应在___ 中进行(填仪器名称)。
26、(10分)实验室欲配制100mL 0.92mol/L的H2SO4溶液
(1)需要用到的仪器,除了烧杯、洗瓶(内盛蒸馏水)、空试剂瓶、玻璃棒、量筒,还必须有 ;
(2)若提供的是18.4mol/L的浓H2SO4,求所需量取的浓H2SO4的体积 mL;
(3)对配制过程中的下列说法,正确的是 。(填序号)
A.量筒量取浓硫酸后要冲洗并将冲洗液一起倒入小烧杯
B.量好体积的浓硫酸应先倒入小烧杯中然后再加水稀释
C.稀释好的稀硫酸要立即转移入容量瓶
D.若定容后摇匀液面又下降了,则不必再补加水至刻度线
(4)配制稀硫酸的容量瓶必须洗涤,若用刚配制过NaCl溶液的容量瓶未洗涤就配制稀硫酸,则所配稀硫酸浓度将 (偏高、偏低、不变);若用刚配制过NaOH溶液的容量瓶未洗涤就配制稀硫酸,则所配制的稀硫酸溶液的浓度将 (偏高、偏低、不变);若用刚配制过HCl溶液的容量瓶未洗涤就配制稀硫酸,则所配稀硫酸浓度将
(偏高、偏低、不变),氢离子浓度将 (偏高、偏低、不变)。
| 得分 | 评卷人 |
五、计算题(共14分)
27.(6分)在含有Na2CO3和Na2SO4的溶液里加入足量的BaCl2溶液,生成43.0g沉淀,把沉淀用足量的盐酸处理,可放出4.4 g CO2气休,则原溶液中所含Na2CO3和Na2SO4的质量分别是多少?(BaCO3:197 BaSO4:233 Na2CO3:106 Na2SO4:142)
28.(8分)用200g 36.5%的盐酸(过量)与17.4g MnO2反应,试回答下列问题:
(1) 理论上能产生标准状况下的氯气多少体积?
(2) 将反应后剩余的溶液过滤,再将滤液用水稀释至500ml,则稀释后的溶液Cl—的物质的量浓度是多少?
(3) 将稀释液取出100ml,加入足量的AgNO3溶液,可生成多少克白色沉淀?