![]()
卤素 姓名 学号 班级 一( )
一
( ) 1.城市公园里给养鱼池换水时,通常是将自来水先通入一备用空池中,在阳光下曝晒一段 时间,然后再加入到养鱼池中,这样做的目的是
A.使水的硬度减小B.使水中的HClO分解 C.起到杀菌作用 D.增加水中O2的含量
( )2.取下列元素①Fe ②Cu ③Mg ④Na 的单质各0.1mol,使其直接跟足量的氯气完全反应,反应后固体增加了10.65g,则下列可能的是
A.Fe B.Cu C.Mg D.Na
( )3.氟气是氧化性最强的非金属单质。在加热条件下,等物质的量氟气与烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是
A.H2 B.HF C.O2 D.OF2
( )4.下列物质中,只含有氯分子的是
(A)液氯 (B)盐酸 (C)氯水 (D)漂白粉
( )5.卤族元素随着原子核电荷数的增加,下列叙述不正确的是
(A)原子半径依次增大 (B)元素的非金属性依次减弱
(C)单质的氧化性依次减弱 (D)氢化物的稳定性依次增强
( )6.下列各组中的物质,都能使碘化钾淀粉溶液变蓝色的是
(A)氯水、溴水、碘水 (B)氯化钠、溴化钠、碘化钠
(C)氯气、氯化氢、氯化钠 (D)氢氟酸、氢氯酸、氢碘酸
( )7.能鉴别NaCl、AgNO3、KI等三种无色溶液的试剂是
(A)稀硝酸 (B)新制氯水 (C)溴化钠溶液 (D)淀粉溶液
( )8.I-和Cl2能够发生反应,说明I-比Cl-的
(A)非金属性强 (B)得电子能力强 (C)氧化性强 (D)还原性强
( )9.下列存放试剂的方法不正确的是
(A)氯气盛放在棕色玻璃瓶中,置于暗处
(B)液溴盛放在无色玻璃瓶中,加一些水,并密封置于低温处
(C)氢氟酸盛放在棕色玻璃瓶中,塞紧玻璃塞
(D)浓盐酸盛放在无色玻璃瓶中,塞紧玻璃塞
( )10.能用分液的方法来分离的一组混合物是
(A)氯化银和水的悬浊液 (B)酒精的水溶液
(C)四氯化碳和水的乳浊液 (D)氯化钠和溴化镁的混合溶液
( )11.在实验室里制取纯净、干燥的氯气,常使产生的氯气通过两个洗气瓶以除去混有的氯化氢和水蒸气,其中第一个洗气瓶中盛装的物质可能是
(A)浓硫酸 (B)烧碱溶液 (C)石灰水 (D)饱和食盐水
( )12.在反应4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,被还原的原子和被氧化的原子的个数比为 (A)1:1 (B)5:2 (C)4:1 (D)1:4
( )13.下列气体中有毒有色的气体是 ( )
A 氟气 B 氟化氢 C 溴化氢 D 一氧
( )14.卤素单质的性质,与F2>Cl2>Br2>I2的变化规律不相符的是 ( )
A 与氢气反应的难易程度 B 非金属活泼性的强弱
C 单质还原性的强弱 D 与水反应的程度
( )15.在一测气管中充入1/4体积氯气、1/4体积氮气、1/2体积氢气,让日光照射一 定时间,待混合气体变为无色,立即将其倒立于盛水的水槽中,则在相同条件下 进入测气管的水的体积占测气管容积的
A 1/2 B 1/3 C 1/4 D 3/4
( )16.往碘化钾溶液中先加入氯水再加入CCl4振荡,静置后分层,下层呈
A 橙红色 B 紫红色 C 无色 D 深褐色
( )17.溴化碘(IBr)是一种卤素互化物,它的化学性质活泼,能与大多数金属反 应
也能与某些非金属单质反应,并能与水发生如下反应:IBr+H20=HBr+HIO
下列有关溴化碘的叙述不正确的是
A 溴化碘与Br2、I2具有相似的化学性质B 在许多反应中, IBr是一种强氧化剂
C 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂
D 溴化碘与氢氧化钠溶液反应时可生成两种盐
18.有A、B、C、D、E五瓶无色溶液,它们分别是HCl、NaI、CaCl2、AgNO3和Na2CO3中的一种。把它们两两混合,发生如下反应:
(1)A+B®白色沉淀 (2)A+C®白色沉淀(3)B+C®白色沉淀
(4)C+E®白色沉淀(5)C+D®黄色沉淀 (6)E+A®无色气体
由此推断:A是 ,B是 ,C是 ,
 D是
,E是
。
D是
,E是
。
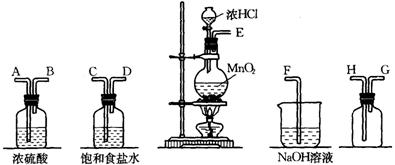
19.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
(1)连接上述仪器的正确顺序是(填各接口处的字母): 接 ,_____接 ,_____接 , 接 。
(2)在装置中:①饱和食盐水起的作用是 ,
②浓硫酸起的作用是 。
(3)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是 ,写出反应方程式 。某同学将试纸长时间放在产生Cl2的导管口,在看到以上现象后,发现试纸又变为无色。写出此时发生的氧化还原方程式 。
(4)写出下列化学反应的离子方程式:
①气体发生装置中进行的反应: ;
②尾气吸收装置中进行的反应: 。
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4溶液和盐酸反应制取Cl2,反应方程式如下,用“双线桥”标出电子转移的方向和数目,并填空:
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
该反应中被氧化和未被氧化盐酸物质的量之比是 ,将该反应改写为离子方程式是: 。如果在1mol·L-1 KCl溶液100mL中用1 mol·L-1 H2SO4溶液100mL酸化,然后滴入足量的KMnO4溶液后微热,理论上最多可生成Cl2 g。
19.向溶有24.9gKI的溶液中先加入8g溴单质,再通人足量的氯气,求反应中
(1) 被溴单质氧化的KI质量;
(2) 被还原的氯气质量。
二
( )1.下列物质不能与氯气直接反应的是
A KOH溶液 B 水 C 氧气 D 铜
( )2.将氯气通入冷的氢氧化钾溶液中,生成的产物有
(1)氧气 (2)水 (3)氯化钾 (4)次氯酸钾
A (2)(3)(4) B (2)(3) C (1)(2)(3) D (1)(2)
( )3.下列物质属于纯净物的是
A 漂白粉 B 胆矾 C 液态空气 D 盐酸
( )4.将氯气不断通入石蕊溶液中,出现的现象是
A 先变红后褪色 B 变蓝 C 先变红后变蓝 D 变红
( )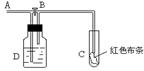 5.如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打
5.如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打
开B阀时,C处红色布条褪色。由此判断正确的是
A、D中可以是浓硫酸 B、通入的氯气含有水份
C、 D中可以是水 D、D中可以是饱和食盐水
( )6.新制氯水与长期存放的氯水比较
A H+较多 B 氧化能力较强 C 漂白能力较弱 D 氯气分子较多
( )7.自来水可以用氯气消毒,某学生用这种自来水去配制下列物质的溶液,
不会产生明显的药品变质问题的是
A AgNO3 B FeCl2 C Na2SO4 D AlCl3
( )8.0.9g某元素的单质直接与氯气反应后,质量增加3.55g,这种元素是
A P B Mg C Al D Fe
( )9.实验室装配制取氯气的气体发生装置时,不需要的仪器是
A 长颈漏斗 B 分液漏斗 C 圆底烧瓶 D 平底烧瓶
( )10.实验室制氯气时,二氧化锰的作用是
A 催化剂 B 氧化剂 C 还原剂 D 反应物
( )11.实验室用KMnO4制氧气,为除去粘附在试管壁上的MnO2,可用试剂是
A 汽油 B 水 C 稀盐酸 D 浓盐酸
( )12.下列气体能被氢氧化钠溶液吸收的是
A 氮气 B 氢气 C 氯气 D 二氧化碳
( )13.87g MnO2与含HCl为146g的浓盐酸共热(不考虑HCl挥发)得到Cl2为
A 142g B 71g C 小于71g D 大于142g
( )14.实验室制氯气时有如下操作,操作顺序正确的是
①连接好装置,检查气密性②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中⑤用向上排空气法收集氯气,尾气导入吸收剂中
A ①②③④⑤ B ④③①②⑤ C ①③④②⑤ D ①④③②⑤
( )15.随着核电荷数的递增,卤族元素的性质递变规律正确的是
①单质颜色加深 ②单质沸点升高 ③单质氧化性增强 ④离子半径增大
⑤ 气态氢化物稳定性增强 ⑥氢化物水溶液的酸性增强
A ①②③ B ④⑤⑥ C ①②④⑥ D ①②③④⑤⑥
( )16.分离碘和碘化物混合物,可以采用的方法是
A 加水 B 加氯水 C 加热 D 加汽油
( )17.能使淀粉碘化钾溶液变蓝的是
A 碘单质 B 溴化钠 C 氯气 D 溴化氢
( )18.下列物质中,分别加入少量溴水,振荡后静止,溶液无色的是
A NaOH溶液 B NaCl溶液 C KI溶液 D Zn粉
( )19.下列液体不能用于从碘水中萃取碘的是
A 汽油 B 酒精 C 四氯化碳 D 苯
( )20.下列试剂不能用带磨砂塞玻璃试剂瓶保存的是
A 苛性钠 B 浓盐酸 C 氢氟酸 D氯酸钾
( )21.已知某溶液中Cl-、Br-、I-的个数比为1∶2∶3,现欲使溶液中Cl-、Br-、I-
的个数比调整为3∶2∶1,则通入氯气的分子数与原溶液中I-个数比是
A 1∶2 B 2∶1 C 3∶1 D 1∶3
( )22.下列物质经阳光照射后,颜色由浅变深的是
A 氯水 B 溴化银 C 溴化钠 D 干冰
( )23.在含NaBr、KI的混合溶液里通入足量的氯气,充分反应后将溶液蒸干,并灼烧残留固体,最后留下的物质是
A KCl和NaCl B NaCl和Br2 C KCl和I2 D KCl、NaCl和I2
( )24.根据卤素性质的递变规律,推测原子半径最大的卤素—砹(At)及其化合物
不可能具有的性质是
A 砹单质为有色固体,易溶于有机溶剂; B HAt十分稳定;
C AgAt为有色的、难溶于水的盐; D NaAt易溶于水。
25.用化学方程式表示下列实验现象:
(1)用自来水配制硝酸银溶液时,出现浑浊;
(2)用自来水配制碘化钾溶液时,溶液呈黄色;
(3)氟单质通人氯化钠溶液中,有气体逸出;
| |
26.写出清洗下列仪器的常用试剂:做过碘升华实验的试管 ; 加热KMnO4制氧气的试管 ;长期盛放石灰水的试剂瓶 。
27.实验室用浓盐酸和足量的二氧化锰反应制氯气,实际产生的氯气总比理论值低,其主要原因是什么?
28.多原子分子氰(CN)2、硫氰(SCN)2、和(OCN)2的性质与卤素单质相似故称它们为类卤化合物。它们可以生成酸和盐(见下表,其中X代表F、Cl、Br或I)
| 卤 素 | 氰 | 硫 氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 钾盐 | KX | KCN | KSCN | ③ |
(1)在表中①、②、③空格处应分别填写 、 、 。
(2)完成下列反应的化学方程式:
① (CN)2与水反应的化学方程式为 ;
② (OCN)2与NaOH反应的离子方程式 。29.某金属M灼热后能在氯气中燃烧,生成氯化物MCl2,当用去7.1g氯气时,可生成13.6gMCl2。请通过计算推测M为何金属?