高一化学期中试卷
注意事项:(1)考试时间为100分钟;
(2)答案一律写在答卷纸上;
(3)可能用到的相对原子质量: H 1;N 14;O 16;C 12; Na 23; Cl 35.5;Ca 40
第Ⅰ卷(选择题)
一、 选择题(本题共25小题,每小题只有一个选项符合题意,每题2分,共50分)
1.下列燃料中,不属于化石燃料的是( )
A.汽油 B.煤 C.天然气 D.氢气
2. 下列物质与水反应最剧烈的是( )
A.Li B.Na C.K D.Rb
3.下列说法中正确的是( )
A.物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量一定等于生成物的总能量
D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
4. 下列反应一定属于氧化还原的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
5.下列用途中与钠无关的是( )
A.用来制取过氧化钠等化合物 B.应用在电光源上
C.用于原子反应堆的导热剂 D.用于制造半导体材料
6.某元素由化合态变成游离态,发生的变化是( )
A. 一定是被氧化 B. 一定是被还原
C. 可能是被氧化,也可能是被还原 D. 不一定是氧化还原反应
7.下表中强电解质、弱电解质、非电解质的分类,正确的是( )
| A | B | C | D | |
| 强电解质 弱电解质 非电解质 | NaOH NH3·H2O 酒精 | CuSO4 CaCO3 水银 | BaSO4 CH3COOH 水银 | CH3COOH 铝 CO2 |
8.按锂、钠、钾、铷、铯的顺序,性质递变正确的是( )
A. 电子层数递减 B. 单质的还原性递增
C. 金属性 递减 D. 熔点和沸点递增
9.焰色反应呈现物质的性质是( )
A. 单质的性质 B. 化合物的性质
C. 离子的性质 D. 元素的性质
10.欲除去二氧化碳气体中混有的氯化氢气体,最好的方法是将混合气体通过( )
A.饱和碳酸氢钠溶液 B. 碳酸钠溶液 C.饱和石灰水 D.氢氧化钠溶液
11.需加入适当的氧化剂才能实现的反应是( )
A. SO2→S B.MnO2→Mn2+
C.Fe→FeCl2 D.SO2→SO32-
12.金属钾投入到氯化铜溶液中,产物是( )
A.KOH和H2 B.Cu(OH)2、KCl、H2
C.Cu和KCl D.HCl、Cu(OH)2、KCl
13.下列对焰色反应实验操作注意事项说明正确的是( )
①K的火焰颜色要透过蓝色的钴玻璃观察.
②没有铂丝可以用光洁无锈的铁丝代替.
③每次实验后要将铂丝用盐酸洗净,并在火焰上灼烧到和火焰颜色一致.
A.全部正确 B.仅①不正确
C.仅②不正确 D.仅③不正确
14.下列各组离子能在水溶液中大量共存的是( )
A. H+、Na+、SO42-、Cl- B. K+、Cu2+、Cl-、OH-
C. Mg2+、Ba2+、CO32-、SO42- D. Ag+、Ca2+、Cl-、NO3-
15.下列说法正确的是( )
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应一定不能自发地进行
16. 下列操作正确的是( )
A.金属钠保存在冷水中 B.直接在托盘天平上称量氢氧化钠
C.过氧化钠可以敞口保存 D.金属钠保存在煤油中
17. 下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
 B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,氧化钠是一种碱性氧化物
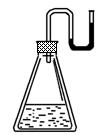
18. 有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;
④CaO固体.现将它们分别装入有水的锥形瓶里,立即塞
紧带U形管的塞子,发现U形管内的滴有红墨水的水面
如右图所示状态,判断加入的物质可能是 ( )
A.①②③④ B.①②④
C.②③④ D.①②③
19. 不能用离子方程式:CO32- + 2H+ = CO2↑+ H2O来表示的反应是( )
A.BaCO3 + HCl B. K2CO3 + H2SO4
C.Na2CO3 + HNO3 D. (NH4)2CO3 + HCl
20. 下列离子方程式书写错误的是( )
A. 碳酸钾溶液与稀硫酸混合 CO32-+2H+==CO2↑+H2O
B. 氯化铜溶液中滴加烧碱溶液 Cu2++2OH-==Cu(OH)2↓
C. 醋酸溶液中加入烧碱溶液 CH3COOH+OH-==H2O+CH3COO-
D. 硫酸溶液中加入氢氧化钡 Ba2++SO42-==BaSO4↓
21. 向饱和的石灰水溶液中不断通入二氧化碳,其溶液的导电性的变化是( )
A. 由弱变强 B. 由强变弱
C. 由强变弱再变强 D. 由弱变强再变弱
22. 鉴别苏打和小苏打固体的最好的试剂是( )
A.水 B.氢氧化钠溶液
C.澄清石灰水 D.氯化钙溶液
23. 已知反应2X-+Z2==2Z-+X2、2W-+X2==2X-+W2能从左向右进行,则反应:
W2+2Z-==Z2+2W-进行的方向是( )
A. 从左向右 B. 从右向左 C. 不能进行 D. 无法判断
24. 将少量Na2O2固体加入到Ca(HCO3)2溶液中,下列有关说法正确的是( )
A.溶液中只有气体产生
B.溶液中只有沉淀产生
C.溶液中有反应:Ca2++OH-+HCO3-=CaCO3↓+H2O发生
D.溶液中有反应:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O发生
25.
R2O8n-
离子在一定条件下可以把Mn2+
离子氧化为MnO4-,若反应后R2O8n- 离子变为RO42-
离子,又知反应中氧化剂与还原剂的个数之比为5:2,则![]() 值是( )
值是( )
A.4 B.3 C.2 D.1
第Ⅱ卷(非选择题)
二.(本题共6小题,共20分)
26.从守恒定律看,一个化学反应中存在着___▲____守恒和____▲_____守恒。
|
28.在反应MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O中,浓盐酸中的 ▲__ 元素被氧化,氧化产物是 ▲__ ;MnO2中的 ▲__ 元素被还原,氧化剂是 ▲__ 。电子转移数目是 ▲__ 。
29.将锌粒投入稀硫酸中,溶液里______▲_______离子的数量减少,____▲________离子数量增加,____▲_____离子数量没有变化,反应的离子方程式是_______▲_________
______________________________________。
30. 将Na2O2固体粉末投入酚酞溶液中,其现象是 ▲ ;化学方程式为 ▲ 。
31.碱金属活动性很强,与氧气反应的情况较为复杂,生成的氧化物有普通氧化物,如Na2O; 过氧化物,如Na2O2; 超氧化物,如KO2 ;臭氧化物,如RbO3 ,其中后三种氧化物都能与水或二氧化碳反应产生氧气。
试分析写出KO2 与水、RbO3与二氧化碳反应的化学方式 ▲__ ,
▲__ 。
现已用平底烧瓶收集到二氧化碳,在平底烧瓶中有一只扎紧在玻璃管末
 端的气球,如下图,打开塞子,迅速往瓶里加入下列物质中
端的气球,如下图,打开塞子,迅速往瓶里加入下列物质中
▲__ (填序号),立即塞紧塞子,一段
时间后,气球就会自动膨胀起来。
A.Na2O B. Na2O2 C .KO2 D .RbO3
三.(本题共2小题,共11分)
32.有A、B、C三种白色固体焰色反应均为紫色(透过蓝色的钴玻璃),它们具有下列性质:①均能溶于水生成无色溶液;②A与B的水溶液反应生成C③加热C和A时均无气体放出,加热B时产生无刺激性气体D,将D通入澄清石灰水生成白色沉淀E;④D与C的水溶液反应可得到B;⑤A过量时与D反应生成C, A不足量时与D反应得到B。
试推断上述各物质的化学式:A ▲__ B ▲__ C ▲__ D ▲__ E ▲ 。
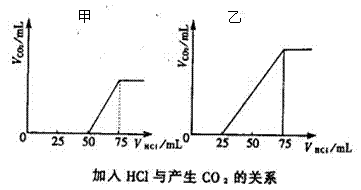 33.向两分等量NaOH溶液中分别通入一定量的CO2,分别得到甲和乙溶液,然后向甲溶液和乙溶液中分别逐滴加入某浓度的盐酸,产生的CO2气体体积与所加入盐酸的体积之间的关系如图所示
33.向两分等量NaOH溶液中分别通入一定量的CO2,分别得到甲和乙溶液,然后向甲溶液和乙溶液中分别逐滴加入某浓度的盐酸,产生的CO2气体体积与所加入盐酸的体积之间的关系如图所示
(1) 当向NaOH溶液中通入CO2气体至过量的过程中,溶液中所含溶质的情况可能有▲_ 、 ▲__、 ▲_、 ▲、 ▲_ (有几种填几种,可不填满)
(2)据甲图判断溶质为 ▲ ,所发生的离子反应方程式为 ▲ 。
据乙图判断溶质为 ▲ ,所发生的离子方程式为 ▲ 。
四.(本题共1小题,共7分)
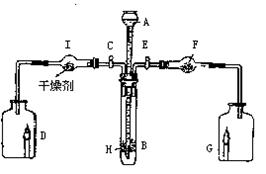
34. 为证明有关物质的性质,某学生设计了右图
所示的装置。当打开活塞C,使液体A与搁板H
上的固体B相遇时,即有气体产生,并发现D中
蜡烛慢慢熄灭;关闭C打开E时,则看到G中
蜡烛燃得更旺,请写出在装置中有关仪器内盛放的物质:
A ▲ ,B ▲ ,F ▲ ,用化学方
程式表示上述实验中发生的有关反应:
▲ 、 ▲ 。
五、计算题(本题共2小题,共12分)
35.在48.9g水中投入1.15g金属钠,二者充分反应(假设反应过程中水无损失)。
(1)写出此反应的离子方程式,并标出电子的转移方向和数目。
(2)试求所得溶液中NaOH的质量分数。
36.将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1.0g,加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体.计算原固体混合物中Na2CO3与NaHCO3的质量。