高一化学第五章测试卷
班级 学号 姓名
可能用到的原子量:H:1 O:16 Cl:35.5 N:14 C:12 Ag:108
一、选择题(1~10题只有一个正确答案,11~20题有1~2个正确答案,请将所选答案填在答题卷上,每题3分共60分)
1. 19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说 B.发现元素周期律 C.提出分子学说 D.最早发现了氧气
2. 据报载我国最近合成多种元素的新的同位素,其中一种是18572Hf(铪),它的中子数是( )
A.72 B.113 C.185 D.257
3. 元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
4. 原子序数在20号以前的元素,原子最外层电子数等于次外层电子数的有( )
A.1种 B.2种 C.3种 D.4种
5. 元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确的化学式为( )
A. Y3X2 B. X2 Y3 C. X2Y3 D. Y2X3
6. 下列物质中既有离子键又有共价键的是( )
A.CaCl2 B.H2O2 C.KOH D.H2S
7. 目前含有元素硒(Se)的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是 ( )
A.原子序数24 B.最高价氧化物为SeO3,为酸性氧化物
C.原子半径比钙小 D.气态氢化物化学式为H2Se,性质不稳定
8.某元素X的最高价氧化物的化学式为X2O5,在它的气态氢化物中含氢3.85%,则该元素的相对原子质量为( )
A.14 B.31 C.74.9 D.121.8
9. 某元素原子的最外层只有2个电子,则该元素( )
A. 一定是ⅡA族元素 B.—定是金属元素
C.一定是正二价元素 D.可能是金属元素,也可能不是金属元素
10. 关于化学键的各种叙述中,下列说法中正确的是 ( )
A.在离子晶体里,只存在离子键 B.共价化合物里,一定不存在离子键
C.非极性键只存在于双原子的单质分子里
D.由不同元素组成的多原子分子里,一定只存在极性键
11. X、Y、Z代表三种不同的短周期元素.X元素的原子最外层只有一个电子;Y元素在周期表 中位于第三周期,与磷元素相邻;Z原子的L电子层有6个电子,由这三种元素组成化合物的化学式可能是( )
A.X3YZ4 B.X4YZ4 C.XYZ2 D.X2YZ4
12.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
| ||||||||||||||||||||||||||||||||||||
|
|
| ||||||||||||||||||||||||||||||||||
13. 科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素.下面关于它的原子结构和性质预测正确的是( )
A.类铅元素原子的最外层电子数为4 B.类铅元素原子核外有6个电子层
C.它的金属性比铅强 D.它的原子半径比铅小
14. 下列各组顺序的排列不正确的是( )
A.离子半径:Na+>Mg2+>Al3+>F- B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3<H2SiO3<H2CO3<H3PO4 D. 阴离子还原性:O2->S2->Se2-
15. 某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
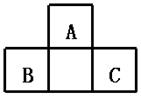 16.A、B、C均为短周期元素,它们在周期表中的位置如下图.已知B、C两元素在周期表中族
序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
16.A、B、C均为短周期元素,它们在周期表中的位置如下图.已知B、C两元素在周期表中族
序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
17. A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.E、C、D、B、A C.B、A、D、C、E D.C、D、A、B、E
18.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:
HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A.原子半径:X>Y>Z B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z D.原子序数:X>Y>Z
19. 在第n电子层中,当它作为原子的最外电子层时,容纳电子数最多与(n-1)层相同。当它作为原子的次外层时,其电子数比(n+1)层最多时多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
20. 有a、b、c、d四种元素。a、b的阳离子与c、d的阴离子具有相同的电子层结构;a的阳离子的正电荷数小于b的阳离子的正电荷数,c的阴离子的负电荷数大于d的阴离子的负电荷数。则它们的离子半径的关系是( )
A.a>b>c>d B.b>a>d>c C.c>a>d>b D.c>d>a>b
二、填空题(21~22题每空1分,23~24题每空2分,共27分)
21. 在原子序数为11—18号的元素中,其单质从水中置换出氢的能力最强的金属元素是_____;化学性质最稳定的物质是_______;结合氢的能力最强的非金属元素是_______;最高氧化物的水化物酸性最强的物质的化学式是________、碱性最强的是______、显两性的是______;原子半径最小的元素是(除稀有气体外)_________;在常温常压下呈气态的单质是_____________.
22.具有双核10个电子的共价化合物的化学式是 ,三核10个电子的共价化合物的化学式是 ,四核10个电子的共价化合物的化学式是 ,五核10个电子的共价化合物的化学式是 .以上四种化合物的热稳定性由小到大的顺序是 .
23. 36克H2O和80克D2O,它们所含的氧原子个数比是_______,它们分别跟金属钠完全反应时,放出的气体体积比(同温同压)是________,质量比是________。
24. 由短周期元素X、Y组成的化合物XY2中共含有30个电子,若XY2为离子化合物时,此化合物的化学式为___________,若XY2为共价化合物时,此化合物的化学式为___________;分别用电子式表示XY2的形成过程_________ ____________和____________________。
三、计算题(25题6分,26题7分)
25.某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20ml恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;Z等于 、A等于 。
(2)X元素在周期表中的位置: 周期 族。
(3)写出X单质与H2O反应的化学方程式: .
26.有相对原子质量均大于10的A、B两种元素,它们之间可形成化合物X和Y.已知等物质的量的X和Y的混合物的密度是相同条件下H2密度的18.5倍,其中X与Y的质量比为3∶4.4,经测定X的组成为AB,Y的组成为A2B.试通过计算确定A、B是什么元素.