高一化学第五章综合检测
A级
一、选择题(1.5分×30=45分)
1.下列关于氧化物的叙述中,正确的是( )
A.酸性氧化物都可以跟强碱溶液反应
B.与水反应可生成酸的氧化物都是酸性氧化物
C.金属氧化物都是酸性氧化物
D.不能跟酸反应的氧化物一定能和碱反应
2.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的相对原子质量为192.22,这两种同位素的原子个数比应是( )
A.39∶61 B.61∶39 C.1∶1 D.39∶11
3.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd、…的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号元素应位于周期表中的( )
A.第6周期ⅣA族 B.第7周期ⅥA族
C.第7周期Ⅷ族 D.第8周期ⅥA族
4.A、B、C、D、E是同一周期的五种主族元素。A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A;C和D的最高价氧化物对应的水化物均呈酸性,且酸性C>D;E是这五种元素中原子半径最小的元素。它们的原子序数由小到大的顺序是( )
A.ABCDE B.CDABE
C.BADCE D.ECDBA
5.A、B分别为第3周期和第4周期的同一主族不同元素的原子,它们原子核内的质子数都等于中子数。①若A为ⅡA族,其质量数为x,则B的质子数为y。②若A为ⅣA族,其质量数为m,则B的质子数为n。在下列各组值中,y和n的值分别是( )
A.(![]() +18)和(2m+18)
B.(
+18)和(2m+18)
B.(![]() +8)和(2m+18)
+8)和(2m+18)
C.(![]() +8)和(2m+36)
D.(
+8)和(2m+36)
D.(![]() +18)和(2m+36)
+18)和(2m+36)
6.A与B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时,A放出的能量大于B。下列叙述中正确的是( )
A.A的氧化性小于B B.A-还原性大于B-
C.A的氧化性大于B D.B-还原性大于A-
7.由ⅢA族元素X和ⅥA族元素Y组成的阴离子,结构如下所示,则所带电荷a、b、c分别为( )
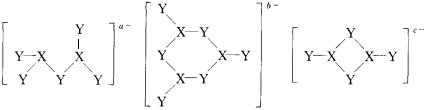
A.2、3、4 B.4、3、2 C.5、6、4 D.2、3、2
8.下列有关元素周期表和周期律的叙述正确的是( )
A.元素的性质随相对原子质量的递增,呈周期性的变化
B.周期表中,原子序数都等于该族元素原子的最外层电子数
C.第三周期中,随核电荷数的递增,元素的离子半径依次减小
D.随核电荷数的递增,ⅦA族元素的单质由上至下熔、沸点升高,碱金属族元素单质由上至下熔、沸点降低
9.同温、同压下,等体积的两个密闭容器分别装有12C18O和14N2两种气体,关于这两个容器中气体的说法正确的是( )
A.质子数相等,质量数不相等 B.分子数和质量数分别不相等
C.分子数、质量数分别相等 D.原子数、中子数、质子数分别相等
10.有几个单核微粒,每个微粒的质子数、电子数都分别相同,它们一定是( )
A.属于同种元素的原子或离子 B.同种核素
C.互为同位素 D.质量数相同的离子
11.有X、Y、Z三种金属,把它们放在稀硫酸中,唯有Y溶解并放出气体,将Z放入X的盐溶液中,有X金属析出,已知X、Y、Z在化合物中均显+2价,则下列结论正确的是( )
A.金属活动性Z>Y>X B.还原性:X>Y>Z
C.氧化性:X2+>Z2+>Y2+ D.氧化性:X2+>Y2+>>Z2+
12.下列叙述正确的是( )
A.两种微粒,若核外电子排布完全相同,则化学性质一定相同
B.由单原子形成的离子,一定具有稀有气体元素原子核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同一种元素
D.阴离子的核外电子排布一定与上一周期稀有气体原子核外电子排布相同
13.有a、b、c、d四种主族元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a阳离子的正电荷数小于b阳离子的正电荷数,c阴离子的负电荷数大于d阴离子的负电荷数,则它们的离子半径的关系是( )
A.a>b>c>d B.b>a>d>c
C.c>a>d>b D.c>d>a>b
14.X、Y、Z分别代表3种不同的短周期元素,X元素的原子最外层电子数为1,Y元素原子M层有6个电子,Z元素原子的L层电子数6,由这三种元素组成的化合物的化学式是( )
A.X3YZ4 B.X2YZ3 C.XYZ4 D.X2YZ4
15.若原子R的质量数为A,Rn-核外电子数为x,则W克Rn-所含中子为( )
A.(A-x+n)mol B.(A-x-n)mol
C.![]() (A-x+n)mol
D.
(A-x+n)mol
D. ![]() (A-x-n)mol
(A-x-n)mol
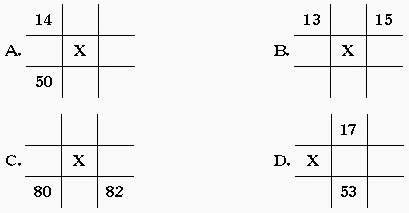
16.下列各图为元素周期表中的一部分,表中的数字为原子序数,X表示硒元素原子序数的是( )
17.R原子核外有3层电子,它的最外层上达到饱和所需电子数小于次外层和最内层电子数之和的![]() ,且等于最内层电子数的正整数倍,关于R的正确的说法是( )
,且等于最内层电子数的正整数倍,关于R的正确的说法是( )
A.常温下能稳定存在的R的氧化物都与烧碱溶液反应
B.R的最高正价氧化物对应水化物都是强酸
C.R易形成离子
D.R的气态氢化物在常温上都能稳定地在空气中存在
18.A和B是前三周期的元素,它们的离子A2-、B3+具有相同的电子层结构。下列说法中正确的是( )
A.原子序数:A>B B.原子半径:A>B
C.离子半径:A2->B3+ D.质量数:A>B
19.已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2-易被氯气氧化;④氯化氢比硫化氢稳定;⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应。上述叙述中可说明氯元素比硫元素非金属性强的是( )
A.①②③ B.②③④ C.③④⑤ D.①③⑤
20.分别处于第二、三周期的主族元素A和B,它们离子的电子层相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B原子核外的电子总数分别为( )
A.m+2、10+n B.m、n
C.3、7 D.m-2、10-n
21.镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A.在化合物中呈+2价 B.单质能使水分解,放出氢气
C.镭比钙的金属性弱 D.碳酸镭难溶于水
22.19世纪末,开始揭示原子内部的秘密,最早发现电子的科学家是( )
A.意大利物理学家阿伏加德罗 B.法国化学家拉瓦锡
C.英国科学家汤姆生 D.英国科学家道尔顿
23.有X、Y两种元素,能生成两种化合物C1和C2,每种化合物的质量分数如下表所示,已知C1的最简式为XY4,则C2的化学式是( )
| X | Y | |
| C1 C2 | 75% 80% | 25% 20% |
A.XY B.X2Y C.XY2 D.X2Y6
24.已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )
A.铍的原子半径大于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数为8
C.氢氧化铍的碱性比氢氧化钙弱
D.单质铍跟冷水反应产生氢气
25.下列说法中,正确的是( )
A.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中一定含有阴离子
B.两种不同的酸混合时,溶液可能呈酸性,也可能呈中性
C.失电子难的原子,其得电子一定容易;得电子难的原子,其失电子一定容易
D.极性分子一定含有极性键,非极性分子一定含有非极性键
26.一些科学家预言,存在稳定的超重元素,如Z=114,N=184的原子,它位于元素周期表第七周期,第ⅣA族,下列说法中正确的是( )
A.第七周期可能有50种元素 B.该原子的质量数为184
C.该原子的质量数为184 D.该原子核外有114个电子
27.A、B分别为第三周期和第四周期同一主族的不同元素的原子,它们原子核内质子数均等于不同元素原子,它们原子核内质子数均等于中子数,若A为第ⅡA族,其质量数为x,则B的质子数为Z;若A为ⅥA族,其质子数为y,则B的质量数为N,Z和N为下列哪一组?( )
A.Z=![]() +16,N=2y+8
+16,N=2y+8
B.Z=2x+16,N=![]() +8
+8
C.Z=![]() +8,N=2y+36
+8,N=2y+36
D.Z=![]() +16,N=2y+36
+16,N=2y+36
28.A、B是同主族的相邻元素,A所在周期共有m种元素,B所在的周期共有n种元素,且m>n,若A的原子序数为x,则B的原子序数可能是( )
①x+m ②x-m ③x+n ④x-n
A.①③ B.②④ C.②③ D.①④
29.在两种短周期元素组成的化合物中,若它们的原子个数之比为1∶3,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )
①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8
A.只有②③ B.只有②③④
C.只有③④ D.①②③④
30.属于短周期的A、B元素,A的原子半径小于B的原子半径,两元素可形成A显正价的AB2型化合物,下列有关A、B两元素的叙述中正确的是( )
A.A、B可能属于同一周期
B.A是B的前一周期元素
C.A只可能是金属元素
D.A可能是第二周期中ⅣA族或ⅡA族元素
二、填空题(共45分)
31.(5分)A、B两种离子具有相同的电子层,A、B两元素的单质都能与水剧烈反应,在反应中A单质为氧化剂,B单质为还原剂。则:
(1)A离子的结构示意图为______________,B原子的结构示意图为______________。
(2)A元素位于______________周期______________族。新发现A的一种含氧酸的化学式为HAO,其中A的化合价为______________。
(3)A单质与水反应的化学方程式为______________。
(4)B单质与水反应的离子方程式为______________。
32.(6分)不同元素的气态原子失去最外层的1个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
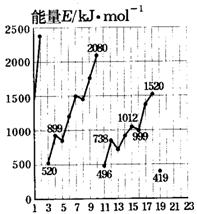
原子序数1至19号元素气态原子失去最外层的1个电子所需能量
(1)同主族内不同元素的E值变化的特点是:______________。各主族中E值的这种变化特点体现了元素性质的______________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是______________。(填写编号,多选倒扣分)
①E(砷)>E(硒)
②E(砷)<E(硒)
③E(溴)>E(硒)
④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层的1个电子所需能量E值的范围:______________<E<______________。
(4)10号元素E值较大的原因是__________________________________。
33.(6分)A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第______________周期______________族,它的最高价氧化物的化学式为______________。
(2)A是______________元素,B是______________元素,D是______________元素。
(3)A与D形成稳定的化合物的化学式为______________,判断该化合物在空气中是否变质的简单方法是______________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________。
34.(3分)有两种气体单质Am和Bn,已知2.4gAm和2.1gBn所含原子个数相同,分子个数比却为2∶3,又知A和B原子核内质子数都等于中子数,且A原子中L电子层所含电子数是K电子层的3倍,试推断:
(1)元素符号:A______________,B______________;
(2)Am中m值是______________。
35.(6分)W、X、Y、Z四种元素的核电荷数均小于18,且依次递增,W原子核内仅有一个质子,X原子的电子总数与Z原子最外层电子数相等,W原子与X原子的最外层电子数之和与Y原子的最外层电子数相等,Z原子L层电子数是K层电子数的3倍,且Z能形成阴离子,由此推断它们的元素符号:W______________,X______________,Y______________,Z______________已知W、X、Z和W、Y、Z分别可组成化合物,其化学式分别为______________、______________。
36.(6分)现有A、B、C三种元素,已知它们的最外层电子数之和等于氧原子最外层电子数,其核内质子数之和不超过18,将它们分别跟O元素结合,均可生成两种氧化物;A+O2→![]() ,B+O2→
,B+O2→![]() ,C+O2→
,C+O2→![]() ,两种氧化物中氧元素质量分数:N>M,E>F,Y>X。M跟X化合,其生成物D可与E形成两种化合物P和Q,其中Q可用来治疗胃酸过多的疾病。据此推断下列元素或化合物(用元素符号或化学式表达)
,两种氧化物中氧元素质量分数:N>M,E>F,Y>X。M跟X化合,其生成物D可与E形成两种化合物P和Q,其中Q可用来治疗胃酸过多的疾病。据此推断下列元素或化合物(用元素符号或化学式表达)
A______________,B______________,C______________;M______________,N______________,E______________,F______________,X______________,Y______________;P______________,Q______________。
37.(6分)A、B、C、D、E为原子序数依次增大的主族元素,已知A、B、E三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:A______________,E______________,D______________。
(2)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式_____________A、E两元素最高价氧化物的水化物相互反应的化学方程式______________________。
(3)比较D、E最高价氧化物对应水化物的酸性。
38.(7分)A、B、C、D四种短周期元素的原子序数依次增大,A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子数之比为4∶1。由A、C组成的两种化合物都为液态,其中一种乙为常用溶剂,乙中A、C原子数之比为2∶1,另一种为1∶1。由D、C组成的两种化合物丙和丁都为固态,丙中D、C原子数之比为1∶1,丁中为2∶1,试写出:
(1)化学式:甲______________,乙______________,丙______________,丁______________。
(2)B元素的最高价氧化物跟丙发生反应的化学方程式为______________________。
(3)甲、乙、丙、丁四种物质中属于碱性氧化物的是______________(可答某物质或无此类物质)。
三、计算题(5分+5分=10分)
39.某元素的同位素ZAX,其氯化物XCl21.11g配成溶液后,需用1mol/L的AgNO3溶液200mL,才能把氯离子完全沉淀下来。已知同位素中有20个中子。
(1)计算X的质量数是多少。
(2)指出X元素在周期表中的位置(周期、族)。
(3)把X的单质放入水中,有何反应现象?滴入的酚酞呈现什么颜色?写出有关的化学方程式。
40.使含重水(D2O)的水分解,得H2、HD、D2的混合气体,现有1L含重水0.017%(质量分数)的水(设其密度为1g/cm3),将其完全分解后,分离得到含HD,D2的混合气体,其平均相对分子质量为3.5。求D2和HD气体的体积(标准状况)。
AA级
一、选择题(2分×25=50分)
1.某元素含有二种质量数不同的原子,这两种原子可以组成三种相对分子质量分别为:2n-2、2n和2n+2的双原子分子,若n为整数,这两种原子的质量数肯定不是( )
A.n+2 B.n+1 C.n-2 D.n-1
2.x原子获得3个电子或Y原子失去2个电子后形成的离子都与OH-具有相同的电子数,X与Y两单质反应得到的化合物化学式为( )
A.Y3X2 B.X3Y2 C.X2Y3 D.Y2X3
3.两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是( )
A.(1)(3)(4)(7)(8) B.(1)(2)(5)(7)(9)
C.(1)(2)(5)(7)(9) D.(1)(2)(3)(4)(5)
4.下列递变情况不正确的是( )
A.Na+、Mg2+、Al3+的氧化性依次增强
B.N、O、F的最高正价依次升高
C.O、S、P的原子半径依次增大
D.P3-、S2-、Cl-的还原性依次减弱
5.已知A、B两元素的原子序数在3~20之间,它们可形成离子化合物AmBn,若A的原子序数为A,则B的原子序数不可能为( )
A.a+8-m-n B.a+16-m-n
C.a-16-m-n D.a-m-n
6.元素X的最高正价和最低负价的绝对值之差为6,Y元素的离子与X元素的离子具有相同的电子层结构,则X、Y形成的化合物可能是( )
A.MgF2 B.K2S C.NaCl D.KCl
7.X元素原子L层比Y元素原子L层少3个电子,Y元素原子核外电子总数比X元素原子核外电子总数多5个,则X、Y两元素的原子序数分别为( )
A.6、11 B.11、6 C.7、12 D.12、7
8.某元素的一种核素,核内质子数为m,中子数为n,关于该元素的下列说法正确的是( )
A.该元素的相对原子质量为m+n
B.该核素的质量为12C的(m+n)倍
C.该核素的同位素核内质子数一定为m
D.核内中子数为n的原子一定是该核素的同位素
9.下列说法不正确的是( )
A.同周期元素,原子核外电子层数一定相同
B.同主族元素,原子最外电子层上的电子数一定相等
C.同周期元素,随原子序数的递增,金属性逐渐减弱,非金属性逐渐增强
D.同主族元素,随原子核外电子层数的增多,得电子能力增强,失电子能力减弱
10.原子序数均不大于20的3种元素X、Y、Z,它们的原子序数之和为42,又知X与Y同周期,Y与Z同主族,下列判断不正确的是( )
A.X和Y不可能在第2周期
B.X和Y若在第4周期,则Z一定在第2周期
C.X和Y若在第3周期,则Z不可能在第4周期
D.X和Y若在第3周期,则Z可能在第2周期
11.A、B两元素形成离子化合物时,一个A原子要失去1个电子转移给B原子,而一个B原子要得到2个A原子的电子。下列有关说法正确的是( )
A.它们形成的离子化合物化学式为A2B
B.原子序数:A一定大于B
C.A和B形成的离子电子层结构一定相同
D.A一定是金属,B一定是非金属
12.下列说法不正确的是( )
A.共价化合物和离子化合物中,一定都含有非金属元素
B.离子化合物中,一定既含有金属元素又含有非金属元素
C.化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D.共价化合物都是由分子构成的,而离子化合物中一般不存在单个分子
13.对于第n电子层,若它作为原子最外层则最多容纳的电子数与n-1层的相同,当它作为次外层,则其容纳的电子数比n+1层上电子最多能多10个电子,则第n层为( )
A.L层 B.M层 C.N层 D.任意
14.已知钡的金属活动性介于钾和钠之间,则下述说法中可能实现的是( )
A.钡可从冷水中置换出氢
B.钡可从氯化钠溶液中置换钠
C.溶液中钡离子可氧化金属锌,使成为锌离子
D.钡可从氯化钾溶液中置换钾
15.aX和bY分别是元素X和元素Y的一种同位素,已知a>b,元素X和元素Y的相对原子质量的关系是( )
A.大于 B.等于 C.小于 D.不能确定
16.氯只有35Cl和37Cl两种稳定的同位素,在氯气中35Cl和37Cl的原子数之比为3∶1。则相对分子质量为70、72、74的氯气分子数之比可能是( )
A.5∶2∶1 B.5∶2∶2 C.9∶3∶1 D.9∶3∶2
17.设某元素原子核内的质子数为m,中子数为n,则下述论断正确的是( )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子质量为wg,此原子的质量为(m+n)wg
D.核内中子的总质量小于质子的总质量
18.某元素(X)构成的双原子单质分子有三种,其相对分子质量分别为158、160、162。在天然单质中,此三种单质的物质的量之比为1∶1∶1,由此推断以下结论中,正确的是( )
A.此元素有3种不同的同位素 B.其中一种同位素质量数为80
C.同位素79X占原子总数的1/2 D.X2的平均相对分子质量为160
19.元素的化学性质主要决定于( )
A.原子的半径 B.原子的外层电子结构
C.元素化合价 D.元素的相对原子质量
20.主族元素X、Y、Z的离子的电子层结构相同,原子半径X>Z,离子半径Y>Z。Y和Z能形成离子化合物,由此可判断三种元素的原子序数是( )
A.X>Y>Z B.Z>X>Y C.Y>X>Z D.X>Z>Y
21.已知元素周期表中的各周期可排列元素数目如下:
周期 1 2 3 4 5 6 7
元素数目 2 8 8 18 18 32 32
人们预测元素周期表第8周期将来也会排满,那么该周期排满时会排( )种元素。
A.18 B.32 C.50 D.无法知道
22.下列说法正确的是( )
A.所有核素的原子核都是由质子和中子构成的
B.石墨和金刚石是由碳元素组成的同位素
C.质量数相同的核素不能称为同位素
D.质子数相同的核素一定是同位素
23.以下对元素的叙述,可以肯定是主族元素的是( )
A.最高价氧化物对应的水化物是酸的元素
B.原子电子层结构中次外层为8个电子的元素
C.元素的最高正化合价为+7价的元素
D.原子电子层结构中最外层为5个电子的元素
24.1934年,约里奥·居里夫妇发现铝(1327Al)受α粒子轰击引起核反应生成中子后,还发射出正电子,核反应先后得到两种新元素的同位素,这两种同位素在元素周期表中的位置是( )
A.第3周期ⅣA族 B.第3周期ⅣA族
C.第3周期ⅤA族 D.第3周期ⅦA族
25.用萃取法从碘水中分离碘,所用萃取剂应具有性质是( )
①不和碘或水起化学反应;②能溶于水;③不溶于水;
④应是极性溶剂;⑤应是非极性溶剂。
A.①②⑤ B.②③④ C.①③⑤ D.①③④
二、填空题(共40分)
26.(5分)X、Y、Z是主族元素的单质,K、H是化合物,它们有如下三个反应(式中各物质的计量数和反应条件已一概略去)
①X+K=H+Y;②X+Z→H;③Y+Z→K。
(1)若X和Y的组成元素不是同一族,请写出(并配平)符合①式的2个不同的化学方程式(2个式子中的2种X和2种Y分别由不同族的元素组成):______________。
(2)今有某化合物W,它跟化合的K和CO2反应都能生成单质Y。符合该条件(题设的3个“通式”)的单质X是______________,单质Y是______________,单质Z是______________,化合物W是______________(均写化学式)
27.(5分)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)
(1)A的化学式是______________,推断的依据是______________。
(2)已知A分子中x个氧原子呈…O—O—O…链状排列,则A分子的电子式是______________,结构式是______________。
28.(7分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生3.36LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
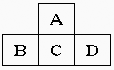
(1)五种元素的名称:A__________,B______________,C____________,D_____________,E______________。
(2)画出C原子、A离子的结构示意图:______________。
(3)B单质在D单质中燃烧,反应现象是______________,生成物的化学式为______________。
(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是___________________________,有关反应的离子方程式为________________。
29.(7分)有X、Y、Z三种元素,其中:X的负价阴离子的原子核外电子排布和氙的原子核外电子排布相同;Y有两种氧化物,其水溶液都呈碱性。在Y的两种氧化物中,Y的质量分数分别是74.19%和58.97%,这两种氧化物的摩尔质量分别是62g·mol-1和78g·mol-1。在X和Y化合生成物的水溶液中滴入Z单质蹬水溶液,溶液由无色变为深黄色。Z和X在同一主族,相差2个周期。试回答:
(1)写出三种元素的名称:X______________,Y______________,Z______________。
(2)两种氧化物分别为______________和______________。
(3)Z的单质溶于不,滴加到X和Y形成的化合物的水溶液中,其离子方程式为(要求标明电子转移方向和总数)______________。
(4)X与Y形成化合物熔点比Z与Y形成的化合物______________,其原因是___________。
(5)用电子式表示Y的质量分数与74.19%的氧化物的形成过程:______________。
30.(4分)已知有关物质的熔、沸点数据如下表:
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2852 | 2072 | 714 | 190(215×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
答:______________________________________________________________________
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是___________。
31.(5分)A、B、C三种元素为短周期元素。A元素的阴离子不能被任何氧化剂氧化,则A离子的结构示意图为______________,它是______________离子。1molB单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是______________;B的最高价氧化物的对应水化物的化学式为______________。C元素有3个电子层,且最外层比L电子层少2个电子,则C元素是______________;C与Na反应后生成物的电子式为______________,化合物中的化学键属于______________。
32.(4分)气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数,B、D、E是中学化学中常见的气体,各物质有如下图所示的转化关系:
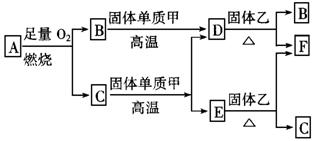
试根据上述条件回答下列问题:
(1)若气体A为混合气体,且X与Y的质量比小于3,则气体A中肯定含有______________。
(2)若气体A为单一气体,且X与Y的质量比等于3,则气体A的名称叫______________。
(3)C与固体甲在高温下反应的化学方程式为_______________________________。
33.(4分)某离子晶体晶胞结构如下图所示,X位于立方体的顶点,Y位于立体中心。试分析:
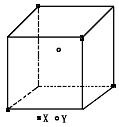
(1)体中每个Y同时吸引着______________个X,每个X同时吸引着______________个Y,该晶体化学式为______________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为______________(填角的度角)。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为Na,则晶体中两个距离最近的X中心间的距离为______________cm。
三、解答题(5分+5分=10分)
34.有A、B、C三种元素,已知5.75gA单质跟盐酸完全反应,在标准状况下可产生2.8L氢气和0.25molACln;B的气态氢化物的分子式为H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1∶2.88,B核内质子数与中子数相等;C和B可以形成CB2型液态化合物,并能溶解B的单质,试回答下列问题:
(1)试通过计算推断A、B、C各是什么元素?
(2)写出A、B的离子结构示意图、B在周期表中的位置、CB2的化学式;
(3)用电子式表示Ca和B形成化合物的过程。
35.某元素的同位素ZAX,它的氯化物XCl21.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
参考答案
A级
一、1.A 2.A 3.B 4.C 5.C 6.CD 7.B 8.D 9.A 10.A 11.C 12.C 13.D 14.BD 15.C 16.D 17.A 18.C 19.B 20.A 21.C 22.C 23.D 24.AC 25.B 26.D 27.C 28.B 29.D 30.BD
二、31.(1)![]()
![]() (2)第二 ⅦA -1
(3)2F2+2H2O=4HF+O2 (4)2Na+2H2O=2Na++2OH-+H2↑
(2)第二 ⅦA -1
(3)2F2+2H2O=4HF+O2 (4)2Na+2H2O=2Na++2OH-+H2↑
32.(1)周期性 (2)①③ (3)419 738 (4)10号是氧元素,该元素原子最外层电子排已达到8电子稳定结构
33.(1)三 ⅦA Cl2O7 (2)Na Mg O (3)Na2O2 观察该化合物的颜色是否变白 (4)Cl2+2OH-=Cl-+ClO-+H2O
34.(1)A∶O B∶N (2)3
解析 A原子中L层电子数是K层的3倍,所以A是O
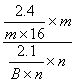 =
=![]() ∴B=14,又∵B原子核内质子数等于中子数,∴B为N。
∴B=14,又∵B原子核内质子数等于中子数,∴B为N。
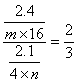 ∴m∶n=3∶2
∴m∶n=3∶2
两种单质分别为O3、N2 ∴m=3。
35.H C N O H2CO3,HNO3
解析 W原子核内只有一个质子,应为H;Z原子L层电子数是K层电子数3倍,应为O;X原子的电子总数与Z原子最外层电子数相等,应为C。
W与X原子最外层电子数之和与Y原子的最外层电子数相等,所以Y最外层有5个电子,又W、X、Y、Z核电荷数依次递增,所以Y应为N。由W、X、Z组成的化合物应为H2CO3,W、Y、Z组成的化合物应为HNO3。
36.H C Na H2O H2O2 CO2 CO Na2O Na2O2 Na2CO3 NaHCO3
37.(1)Na Si P (2)Al(OH)3+NaOH=NaAlO2+2H2O NaOH+HClO4=NaClO4+H2O (3)H3PO4>H4SiO4
38.(1)CH4 H2O Na2O2 Na2O (2)2Na2O2+2CO=2Na2CO3+O2 (3)Na2O
39.(1)40 (2)4,ⅡA (3)与水反应有气泡产生 红色 Ca+2H2O=Ca(OH)2+H2↑
解析 设X的质量数为Y
XCl2 + 2AgNO3=X(NO3)2+2AgCl↓
Y+71g 2mol
1.11g 1mol/L×100×10-3L
![]() Y=40
Y=40
又∵X中有20个中子,∴X中应含20个质子,位于周期表中第四周期ⅡA族。
40.(1)VD2=0.13L VHD=0.13L
解析 1L水中含重水 1L×1000g/L×0.017%=0.17g
重水(即D2O)的物质的量为![]() =0.0085mol
=0.0085mol
重氢(D)的物质的量为0.0085×2=0.017
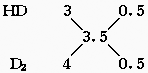
∴nHD∶nD2=1∶1
依D原子守恒可知:nHD+2nD2=0.017
∴nHD=nD2=![]() mol
mol
∴VHD=VD2=![]() mol×22.4L/mol=0.1289L=0.13L
mol×22.4L/mol=0.1289L=0.13L
AA级
一、1.AC 2.A 3.A 4.B 5.C 6.D 7.C 8.C 9.D 10.C 11.AD 12.BD 13.B 14.A 15.D 16.AD 17.A 18.CD 19.B 20.B 21.C 22.CD 23.BD 24.BC 25.C
二、26.(1)2Al+6HCl=2AlCl3+3H2↑ 2F2+2H2O=4HF+O2↑。 (2)F2 O2 H2 Na2O2
27.(1)O3F2,阿伏加德罗定律及质量守恒定律 (2)![]() ,F—O—O—O—F
,F—O—O—O—F
28.(1)A:O B:P C:S D:Cl E:Al
(2)C原子:![]() A离子:
A离子:![]()
(3)白色烟雾 PCl3、PCl5
(4)Al2O3 两性氧化物
(5)先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
29.(1)碘
钠 氯 (2)Na2O Na2O (3)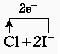 =2Cl-+I2
(4)低
I-离子半径大于Cl-离子半径,NaI离子键比NaCl弱,故NaI的熔点比NaCl低。
=2Cl-+I2
(4)低
I-离子半径大于Cl-离子半径,NaI离子键比NaCl弱,故NaI的熔点比NaCl低。
(5)![]()
30.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,不便于操作。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,不能被电解。(2)将两种晶体加热到熔化状态,MgCl2能导电,AlCl3不能导电,故确证MgCl2为离子晶体,AlCl3为分子晶体。要注意由于MgCl2、AlCl3溶于水都能电解,不能用它们的溶液作导电性实验来证明所属晶体类型。
31.![]() 氟 Al
Al(OH)3 S
氟 Al
Al(OH)3 S ![]() 离子键
离子键
32.(1)H2 (2)甲烷 (3)H2O+C![]() CO+H2
CO+H2
33.(1)4 8 XY2(或Y2X) (2)12 (3)109°28′ (4)
三、34.(1)A为钠,B为硫,C为碳 (2)![]()
![]() B在第三周期ⅥA族,CB2化学式为CS2 (3)
B在第三周期ⅥA族,CB2化学式为CS2 (3)![]()
35.(1)Z=20,A=40 (2)第四周期,ⅡA族 (3)有气泡产生,Ca+2H2O=Ca(OH)2+H2↑