高一下学期第五次周练化学试题(碳族元素无机非金属材料)
相对原子质量:H:1 C:12 O:16 Na:23 Si:28 Ca:40
第Ⅰ卷(选择题共46分)
一、选择题(每小题2分,共16分)每小题只有1个选项符合题意。
1.下面关于碳族元素的叙述,不正确的是
A.碳族元素的非金属性比同周期的氧族元素的非金属性弱
B.碳族元素的单质通常情况下都能导电
C.自然界中存在着碳族元素中某元素的气态氢化物
D.碳族元素中有自然界中最硬的单质
2. 石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线路、电力设备的损坏,这是由于石墨
A. 有放射性 B. 易燃、易爆 C. 能导电 D. 有剧毒
3.下列各组物质中,不互为同素异形体的是
A.石墨和C60 B.晶体硅和无定形硅 C.H2和D2 D.O2和O3
4. 某元素最高正价与最低负价的代数和为零,它的气态氢化物中氢的质量分数25%,该元素是
A. C B.Si C.S D.Cl
5.下列变化不可能一步实现的是
A.SiO2→H2SiO3 B.CO2 →H2CO3 C.SiO2→CaSiO3 D.CO2 →CaCO3
6.某些保健品中有锗元素,则有关锗的叙述正确的是
A.锗在周期表中的第3周期第ⅣA族 B.锗的金属活动性比钠强
C.锗的原子序数为34 D.单质锗是半导体材料
7.下列溶液中通入过量二氧化碳仍能产生沉淀的是
A. 漂白粉溶液 B. 氯化钙溶液 C. 石灰水 D. 饱和碳酸钠溶液
8.下列说法正确的是
A.二氧化硅是酸性氧化物,它不溶于任何酸 B.石英的主要成分为SiO2
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是硅酸的酸酐,所以二氧化硅与水反应可得到硅酸。
二、选择题(每小题3分,共30分)每小题有l-2个选项符合题意。
9.某无色混合气体可能含有CO2、CO、H2O、H2中的一种或几种,依次进行如下连续处理(假定每步处理反应完全)通过碱石灰时,气体体积减小;通过赤热的的氧化铜时固体变为红色;通过白色硫酸铜粉末时,粉末变为蓝色;通过澄清石灰水时,溶液变得浑浊。由此可以确定原混合气体中
A.一定含有CO2、H2O,至少含有H2、CO中的一种
B.一定含有H2O、CO,至少含有CO2、H2中的一种
C.一定含有CO、CO2,至少含有H2O、H2中的一种
D.一定含有CO、H2,至少含有H2O、CO2中的一种
10.下列物质①氢氟酸 ②浓硫酸 ③烧碱溶液 ④碳酸钠固体 ⑤氧化钙 ⑥浓硝酸其中,在一定条件下能与二氧化硅反应的是
A.①②⑥ B.全部 C.①③④⑤ D.②③⑥
11. 下列离子方程式书写不正确的是
A.石英溶于烧碱溶液:SiO2 +2OH- =SiO32- +H2O
B.碳酸钙与硝酸反应 :CO32- +2H+ =H2O +CO2↑
C.碳酸钠溶液中通人CO2气体 :CO32-+CO2 +H2O=2 HCO3-
D.碳酸氢钙溶液中加入足量氢氧化钠溶液:
|
12.工业上制造金刚砂(SiC)的化学方程式:SiO2 + 3C SiC+ 2CO↑ 在这个氧化还原方程式中,氧化剂和还原剂物质的量比是
A.1:2 B.2:1 C.5:3 D.3:5
13. 高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是
A. 7,2 B. 5,4 C. 6,3 D. 3,6
14.能用带有玻璃塞的磨口试剂瓶里保存的溶液是
A.烧碱溶液 B.胆矾溶液 C.水玻璃 D. 氢氟酸
15.下列说法均摘自某科普杂志,你认为无科学性错误的是
A.铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
B.CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒
C.“汽水”浇灌植物有一定的道理,其中CO2的缓释,有利于植物的光合作用
D.硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂”
16.在标准状况下 将CO2和CO的混合气体(密度为10/7 g/L),充满一盛有足够Na2O2的密闭容器中(容积为22.4L),用间断的电火花引发至充分反应,反应完成后,对容器里存在的物质的叙述正确的是
A.存在0.5molCO B.存在0.125molO2
C.存在0.25molNa2CO3 D.存在0.5molNa2CO3
17.下列说法正确的是
A.纳米材料是指一种称为“纳米”的新物质制成的材料
B.普通玻璃呈淡绿色是由于含有Fe3+
C.光导纤维是以二氧化硅为主要原料制成的一种新型无机非金属材料
D.氮化硅陶瓷可用作陶瓷发动机的材料
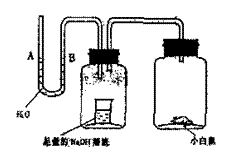 18. 请据图回答,经数小时后,U型管A、B两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)
18. 请据图回答,经数小时后,U型管A、B两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)
A、A处上升,B处下降
B、A、B两处都下降
C、A处下降,B处上升
D、A、B两处都不变
第Ⅱ卷(非选择题共54分)
选择题答题栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、填空题(本题包括3小题,共26分)
19.(6分)课本上说“碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的。”
⑴根据上一句话判断:锡的+2价化合物(如SnCl2)应具有较强的 性,铅的+4价化合物应具有较强的 性。
⑵铅有一种重要的“混合型”氧化物Pb3O4,若将该氧化物的化学式写成xPbaOb·yPbmOn的形式,其具体的化学式应写成 。
⑶PbO2与浓盐酸可发生氧化还原反应生成Cl2,该反应的方程式为:
。
20.(10分)
⑴制造水泥的主要原料是 ,制造玻璃的主要原料是
。
⑵将下列天然硅酸盐改写成氧化物的形式:
①石棉 ![]() ________________
________________
②白云母K2H4Al6Si6O24________________
⑶普通玻璃用氧化物形式表示其组成为Na2O·CaO·6SiO2,则1kg普通玻璃中含有Na2SiO3 g,CaSiO3 g 。
21.(10分)已知A是一种不溶于水的酸酐。根据下图转化关系回答:
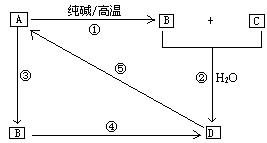
⑴A是 ,B是 ,D是 。
⑵写出①→⑤各步反应的化学方程式,如是离子反应请改写离子方程式。
①
②
③
④
⑤
四、实验题(1小题,14分)
22.某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:
⑴定性分析
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
②请你设计一个简单的实验方案,确认样品中含有CO32-离子。
⑵定量分析
该小组同学设计了下图所示装置,测定天然碱的化学组成。
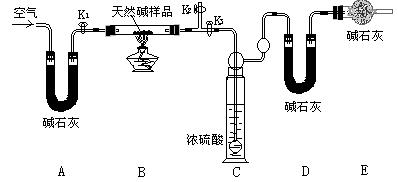
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是
。A处碱石灰的作用是 。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6g,装碱石灰的U形管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶的质量为88.5g;装碱石灰的U形管D的质量为75.8g。该步骤中缓缓鼓入空气数分钟的目的是
。
计算推导:
该天然碱的化学式为 。
五、计算题(本题包括2小题,共14分)
23.(6分)第ⅣA族元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。
⑴试求n和m的值
n== m==
⑵试求R的相对原子质量a:
a==
24.(8分)把26g含有SiO2的CaCO3固体在高温下加热到质量不再改变;冷却后称量为17.2g。试通过计算回答下列问题:
⑴有关反应的化学方程式是
, 。
(2)生成的CO2在标准状况下的体积是多少升?
(3)原物质中含SiO2多少克?
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | C | A | A | D | D | B | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | B D | A | B | B | C D | B | C D | C |
三、填空题
19. ⑴还原性 氧化性 ⑵2PbO·PbO2 ⑶![]()
20. ⑴黏土和石灰石 ;纯碱、石灰石、石英。 ⑵CaO·3MgO·4SiO2 K2O·3Al2O3·6SiO2·2H2O ⑶255g 243g
21. ⑴SiO2 Na2SiO3 H2SiO3
⑵ 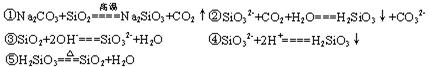
四、实验题:
22 ⑴①不能说明。因天然碱样品中的NaHCO3受热分解也可产生水。
②取天然碱样品溶于水,加入足量的CaCl2(或BaCl2)溶液,过滤并洗涤沉淀,向沉淀中加入稀盐酸,产生的气体通入澄清石灰水变浑浊,说明样品中含有CO32- 。
⑵①检查装置的气密性。除去通入空气中的CO2和H2O。⑤使反应生成的CO2和H2O被碱石灰充分吸收。 Na2CO3·2NaHCO3·H2O
五、计算题:
23. ⑴n==2 m==4 ⑵a==119
24. ![]()
![]()
⑵ 4.48L ⑶ 6 g