第七章 硅和硅酸盐单元综合测试
段段清——
姓名: 作业时限:9 0分钟 满分:100分 得分:
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有1个选项符合题意。)
1.近年来出现了一些新的碳单质,如C60、C70等。C60、C70、金刚石、石墨都是碳元素的( )。
(A)同位素 (B)同素异形体
(C)同一元素 (D)同一物质
2.随着原子序数的递增,单质的熔沸点依次升高的族是( )。
(A)碱金属 (B)卤素
(C)碳族 (D)氮族
3.下列物质中,既不能导电,又不能溶解于水的是( )。
(A)硅藻土 (B)石墨
|
4.工业上制造金刚砂(SiC)的化学方程式如下:SiO2+3C====SiC+2CO↑,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )。
(A)1:2 (B)2:1
(C)1:1 (D)3:5
5.关于玻璃的叙述中,错误的是( )。
(A)不是晶体,没有一定的熔点
(B)普通玻璃组成可用Na2O·CaO·6SiO2表示
(C)氢氟酸能腐蚀玻璃,是因为氢氟酸是强酸
(D)制造普通玻璃的原料中,石英是多量的
6.铅的氧化物较多,其中Pb3O4可以看成是由铅的最高价氧化物与最低价氧化物形成的复杂化合物。在Pb3O4中,铅的最低价氧化物与最高价氧化物的物质的量之比是( )。
(A)1:1 (B)1:2
(C)2:1 (D)无法确定
7.由4.14gPb经氧化后得到氧化物的质量为4.46g,则生成的氧化物是( )。
(A)PbO (B)PbO2
(C)Pb3O4 (D)Pb2O3
8.下列物质中,能使品红溶液褪色,但不发生化学反应的是( )。
(A)活性炭 (B)过氧化钠
(C)氯化钙 (D)次氯酸钙
二、选择题(本题包括10小题,每小题3分,共30分。每小题有1~2个选项符合题意。)
9.下列关于元素X的叙述中,能够说明X一定属于第1VA族的是( )。
(A)最高正价与最低负价的绝对值相等
(B)原子最外层有4个电子
(C)最高价氧化物的水化物为弱酸
(D)单质晶体是一种半导体材料
10.下列叙述正确的是( )。
(A)CH4、SiH4、SnH4的热稳定性逐渐增强
(B)任何一种碳族元素的主要化合价都表现为+2价和+4价
(C)石墨在特定条件下可转变为金刚石,因为金刚石和石墨均用符号“C”表示,所以这种变化
属于物理变化
(D)实验室里不能用石灰石和稀硫酸反应制取CO2
11.某元素X的核外电子数等于核内中子数。取该元素单质2.8g,与氧气充分反应可得到6g氧化物XO2,该元素在元素周期表的位置是( )
(A)第三周期 (B)第二周期
(C)第1VA族 (D)第VIA族
12.下列叙述中所指的非金属元素,气态氢化物最不稳定的是( )。
(A)构成矿物和岩石的主要元素
(B)空气中含量最多的元素
(C)有两种氧化物,有一种是含氧50%的元素
(D)单质在常温下呈液态的元素
13.一种无色气体X和灼热的木炭反应,得到另一种气体Y,Y和红热CuO反应又得到气体 X,下列组合最合理的是( )。
(A)X:CO2,Y:CO (B)X:O2,Y:CO
(C)X:CO,Y:CO2 (D)X:O2,Y:CO2
14.把N2、O2、CO2按体积比为2:1:1混合后,通过很厚的灼热炭层,使其充分反应,所得混合气体中CO占总体积的( )。
(A)![]() (B)
(B)![]() (C)
(C)![]() (D)
(D)![]()
15.“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留青白在人间。”这是明朝诗人于谦的著名诗句。其中包含的化学变化有( )。
(A)两个 (B)一个
(C)三个 (D)四个
16.能溶解SiO2的物质是( )。
(A)硝酸 (B)盐酸
(C)氢氟酸 (D)烧碱溶液
17.现有硅酸钠、石灰石、二氧化硅等三种白色粉末,试用一种试剂鉴别它们。这种试剂最好是下列中的( )。
(A)火碱 (B)盐酸
18.两个原硅酸分子中的氢氧原子团可以相互作用脱去一个水分子:2H4SiO4=H6Si2O6+ H2O,则在所得的H6Si2O6分子结构中含有硅氧键的数目是( )。
(A)5 (B)6 (C)7 (D)8
三、本题包括3小题,共18分。
19.(5分)操作方法和化学方程式填入表中空格。
| 操作方法 | 化学方程式 | |
| ①SiO2(CaCO3) | ||
| ②CaCO3 SiO2) | ||
| ③SiO2 (CaO) | ||
| ④SiO2 (S) | ||
| ⑤SiO2 (Fe2O3) |
20.(5分)检验CO中混有的CO2,所用的试剂是____________;除去CO中混有的CO2,所用的试剂是____________;除去CO2中混有的CO,可将混合气体通过____________;除去CO2中混有的O2,可将混合气体通过____________;除去CaO中混有的CaCO3,可采取的方法是_________________________________________。
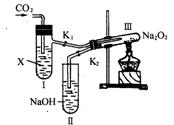 21.(8分)“二氧化碳是否在有水存在时才能与过氧化钠反应?”这个问题可以在实验室里通过以下实验加以证明:
21.(8分)“二氧化碳是否在有水存在时才能与过氧化钠反应?”这个问题可以在实验室里通过以下实验加以证明:
(1)按图示装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先用弹簧夹(K1、K2)夹持好,目的何在? ___________________________________________________________________________________。
(2)试管Ⅰ内的试剂X应该是___________,打开弹簧夹K1、K2,加热试管Ⅲ约5min将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧,且Ⅲ内淡黄色未发生变化,则所得的化学结论是_____________________________________________________________________________。
(3)试管Ⅰ内试剂为CO2饱和水溶液时,其它操作同(2),通过______________________现象以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)CO2与Na2O2反应机理也可用示踪原子分析加以证明。请完成下列反应:
Na2O2+C18O2+H218O→
四、本题包括3小题,共23分。
22.(6分)某些保健品中有锗元素,锗的单质晶体是一种良好的半导体材料,广泛应用于电子工业,锗可以从燃烧所得的烟道灰中提取,提取过程如下:
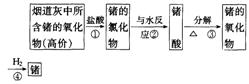
试写出上述过程中各步反应的化学方程式。
23.(6分)图中每一方格表示有关的一种反应物或生成物,其中B是一种单质,其余物质也都是含有B元素的化合物。C是一种钠盐,E是C对应的酸,B和D的晶体均为原子晶体。其它不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去。
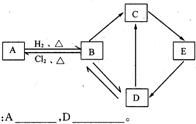
请填写下列空白:
(1)有关物质的化学式:A________________,D________________。
(2)A和B的互变在工业上的实际意义: _____________________________________________________________________________。
(3)写出D→C的反应的化学方程式:________________________________________________________________________________。
24.(11分)将玻璃窑里出来的气体通入灼热的固体A,能生成另一种气体B,B气体能和O2反应生成 气体C,它与玻璃窑放出的气体完全相同。C与NaOH反应能生成D,也可生成E,但D还可以与NaOH反应生成E。固体D受热可分解生成E、C和水。A与SO2反应生成B也可生成C。
(1)写出上述物质的化学式:
A________________,B________________,C________________,D________________,E________________。
(2)写出下列转化关系的化学方程式:
C+A→B:
________________________________。
C+NaOH→D:
________________________________。
D+NaOH→E:
________________________________。
四、本题包括2小题,共13分。
25.(6分)向含0.1 mol Ca(OH)2的石灰水中通入3.36 L(标准状况)CO2,充分反应后,能产生多少克沉淀?要使沉淀及所在的混合溶液与200mL盐酸恰好反应至中性溶液,则该盐酸的物质的量浓度是多少?
26.(7分)检验某病人血液中的含钙量,取10mL血液,稀释后用(NH4)2SO4溶液处理,生成CaC2O4沉 淀,过滤沉淀将其溶于强酸中,然后用0.5 mol,/L KMnO4溶液滴定,用去高锰酸钾溶液1.20mL。有关反应如下:
Ca2++C2O42—=CaC2O4↓
CaC2O4+H2SO4=CaSO4+ H2C2O4
2 H2SO4 + H2C2O4+2KMnO4
=K2SO4+2MnSO4+10CO2↑+8H2O计算病人血液中的含钙量(g/L)。
第七章 硅和硅酸盐
段段清——单元综合测试
一、1.(B) 2.(B) 3.(A) 4.(A) 5.(C) 6. (C) 7.(A) 8.(A)
二、9.(A)、(B) 10.(B)、(D) 11.(A)、(C) 12.(A) 13.(A) 14,(C) 15.(C) 16.(C)、(D) 17.(B) 18.(D)
三、19.①加盐酸、过滤 CaCO3+2HCl=CaCl2+CO2↑+H2O ②加氢氟酸,过滤 SiO2+4HF=SiF4↑+
+2H2O ③加盐酸,过滤 CaO+2HCl=CaCl2+H2O ④加CS2溶液,过滤、无 ⑤加盐酸,过滤 Fe2O3+6HCl=2FeCl3+3H2O
20.澄清石灰水 NaOH溶液 灼热的CuO;灼热的铜网 高温煅烧
21.(1)以防止试管Ⅲ内的Na2O2和外界相通时发生吸潮现象 (2)浓H2SO4 Na2O2和干燥的CO2不反应 (3)带火星的小木条在试管Ⅱ的液面上剧烈燃烧,同时Ⅲ内Na2O2淡黄色变为白色 (4)2 Na2O2+2 C18O2+2H218O=2Na218O3+ O2↑+2H2O
|
GeO2+2H2====Ge+2H2O
23.(1)SiCl4 SiO2 (2)由粗硅制取高纯度的精硅 (3) SiO2+2NaOH=Na2SiO3+H2O
|
(2)C+ CO2===2CO CO2+NaOH=NaHCO3 NaHCO3+NaOH=Na2CO3+H2O
五、25.3.36 LCO2, 即3.36=0.15(mo1)。
Ca(OH)2+CO2=CaCO3↓+H2O
0.1 mol 0.1 mol 0.1 mol
CaCO3+ CO2 +H2O = Ca(HCO3)2
0.05 mol 0.05 mol 0.05 mol 得沉淀0.05×100=5(g)。
CaCO3+ 2HCl = CaCl2+CO2↑ +H2O
0.05 mol 0.1 mol
Ca(HCO3)2+ 2HCl = CaCl2+2CO2↑+2H2O
0.05 mol 0.1 mol
消耗盐酸0.1+0.1=0.2(mol)。故该盐酸物质的量浓度为![]() =1(mol/L)。
=1(mol/L)。
26.6g/L