高一化学同步测试(4)—《钠的化合物》
一、选择题(每小题3分,共10题,计30分,每小题只有一个正确答案)
1.在自然界中能存在的物质是 ( )
A.钠 B.氢氧化钠 C.过氧化钠 D.碳酸钠
2.Na2O和Na2O2的共同之处是 ( )
A.均是白色固体 B.都能与水反应生成碱
C.都具有漂白作用 D.都为碱性氧化物
3.下列说法中不正确的是 ( )
A.Na2CO3 和NaHCO3均可与HCl反应
B.Na2CO3比NaHCO3易溶于水
C.Na2CO3的稳定性比NaHCO3强
D.Na2CO3能与石灰水反应而NaHCO3不反应
4.对2Na2O2+2CO2==2Na2CO3+O2下列说法正确的是 ( )
A.是氧化还原反应,Na2O2是氧化剂,CO2是还原剂
B.是氧化还原反应,CO2是氧化剂,Na2O2是还原剂
C.不是氧化还原反应,是碱性氧化和酸性氧化物反应
D.是氧化还原反应,Na2O2既是氧化剂,又是还原剂
5.除去CO2气体中混有的少量HCl气体,最好将混合气体通过 ( )
A.烧碱溶液 B.饱和的碳酸氢钠溶液
C.碳酸钠溶液 D.浓硫酸
6.称量NaOH固体的质量时,不能把它放在纸上称量而是放在已知质量的烧杯中进行称量
的主要原因是 ( )
A.因为放在烧杯中称量比放在纸上称量更准确
B.因为配制溶液是在烧杯中进行,直接放在烧杯中称量会减少操作过程
C.因NaOH易潮解且有强腐蚀性
D.因为放在纸上称量会混有杂质,降低所配制溶液的纯度
7.把agNa2O和bgNa2O2分别加入等质量的水中(水为足量),结果得到同质量分数的溶液,
由此判断a与b的关系为 ( )
A.a=b B.a<b C.a>b
8.把2.1g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固
体中,固体的质量增加 ( )
A.2.1g B.3.6g C.7.2g D.无法确定
9.过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残
留的是 ( )
A.Na2CO3和Na2O2 B.只有Na2CO3
C.Na2CO3和NaOH D.Na2O和NaHCO3
10.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,
下列说法正确的是 ( )
A.溶液中Na+浓度增大,有O2放出 B.溶液的OH-浓度不变,有H2放出
C.溶液中Na+数目减少,有O2放出 D.OH-浓度增大,有O2放出
二、选择题:(每小题有1—2个答案,共5小题,每小题4分,共20分)
11.某干燥粉末可能由Na2O , Na2O2 , Na2CO3, NaHCO3, NaCl中的一种或几种组成。将该粉
末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压
下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质
量大于原混合粉末的质量。下列判断正确的是 ( )
A.粉末中一定有Na2O、Na2O2、NaHCO3
B.粉末中一定不含有Na2CO3和NaCl
C.粉末中一定不含有Na2O和NaCl
D.无法肯定粉末里是否含有Na2CO3和NaCl
12.可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是 ( )
A.加热时有无色气体放出
B.滴加盐酸时有无气泡放出
C.溶于水后,滴加稀的氯化镁溶液有无白色沉淀生成
D.溶于水后,滴加澄清石 灰水,有无白色沉淀生成
13.加热mg质量分数相等的Na2CO3和NaHCO3混合物,一段时间后,质量变为ng,当
NaHCO3完全分解时,n的值为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14.向含有下列离子的水溶液中,加入一小块金属钠,引起离子数目减少的是 ( )
A.CO32- B.OH- C.HCO3- D.Cu2+
15.将O2、CH4、Na2O2放入密闭容器中,在150℃条件下用电火花引发反应后,容器中的
压强为零,由此得出原O2、CH4、Na2O2的质量比为 ( )
A.16:8:39 B.4:4:39 C.96:16:39 D.8:8:117
三、填空题:(39分)
16.(5分)氧化钠是一种________色固体,溶于水时跟水反应生成________,反应的化学方
程式为________________________________________,它是一种________性氧化物,当
它与CO2反应时则生成________________________。
17.(6分)碳酸钠俗名________或________,是一种________色________体,含10个结晶
水的碳酸钠的化学式________________,写出碳酸钠与盐酸反应的离子方程式______
__________________________________________________________________。
18.(6分)钠与氢气在加热条件下反应生成氢化钠(NaH),NaH在熔融状态下能导电。取
少量氢化钠溶于水能剧烈反应,生成碱性溶液和一种可燃性气体。
写出钠与氢气反应的化学方程式________________________________________。
写出NaH与H2O的反应的化学方程式________________________________________,
反应中NaH作为________剂。
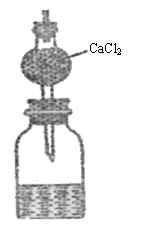 19.(8分)测定某种碱金属的相对原子质量设计的装置如图所示。该装置的总质量(包括水)
19.(8分)测定某种碱金属的相对原子质量设计的装置如图所示。该装置的总质量(包括水)
为ag,将质量为bg的碱金属投入水中,立即塞紧瓶塞
(水过量),完全反应后再称此装置的总质量为cg。则:
(1)列出计算该碱金属相对原子质量的数学表达式
_ _______________。
(2)无水CaCl2的作用是_________________________。
(3)如不用无水CaCl2,求出的相对原子质量比实际相对
原子质量_____ ___(填“偏大”、“偏小”),
理由是________________________________________。
20.(8分)(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O2___________________________ ②Na2O________________________。
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应
的化学方程式:______________________________________________。
(3)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反
| |
21.(6分)在一密闭容器中放有11.5gNA.4.4gCO2、5.4g水蒸气,此时压强为1.01×105Pa。
放置一段时间,保持温度不变,让几种物质充分反应。
(1)瓶中可能发生的反应方程式为_________________________________________。
(2)反应后容器中物质的总质量为_____________克。
(3)反应后残留固体成分及各成分的质量分别为_______________。
四、计算题:(11分)
22.(4分)有Na2CO3、NaHCO3、NaCl的固体混合物4g,现将其加热到质量不再减少为止,
冷却后称其质量为3.38g。在残存固体中加入过量盐酸产生CO20.88g,试求:
(1)原混合物中NaHCO3的质量。
(2)原混合物中NaCl的质量。
23.(7分)一定质量的小苏打粉末经充分加热后,质量比原来减少了3.1g,剩余物的质量为
Ag;相同质量的小苏打和一定质量的结晶苏打((Na2CO3·xH2O)的混合物,经充分加热
后,质量比原来减少了10.3g,剩余物质的质量为Bg;又知B∶A=2∶1。试求:
(1)原小苏打和结晶苏打的质量;
(2)结晶苏打化学式中x的值。
四、《钠的化合物》
一、选择题:
1、D 2、B 3、D 4、D 5、B 6、C 7、C 8、A 9、B 10、C
二、选择题:11、AD 12、C 13、B 14、CD 15、D
三、填空题:
16、白 NaOH Na2O+H2O==2NaOH 碱 Na2CO3
17、纯碱 苏打 白 固 Na2CO3·10H2O
CO+2H+==CO2↑+H2O 或 CO+H+==HCO
18、2Na+H2 2NaH NaH+H2O==NaOH+H2↑还原
|
|
20、(1)2Na+O2 Na2O2 4Na+O2 2Na2O
(2)4KO2+2CO2==2K2CO3+3O2 (3)2O+2H2O==H2O2+O2+2OH-
21、(1)2Na+2H2O==2NaOH+H2↑ CO2+2NaOH==Na2CO3+H2O CO2+NaOH==NaHCO3
(2)质量守恒 21.3g (3)Na:2.3g NaOH:8g Na2CO3:10.6g
四、计算题:
|
23、解:(1)2NaHCO3 Na2CO3
+H2O+CO2↑
168 106 62 △m=62
m(NaHCO3) A △m' =3.1g
∴m(NaHCO3)=8.4g A=5.3g (2分)
减少的H2O的质量为10.3g- 3.1g =7.2g
Na2CO3·xH2O==Na2CO3 + xH2O
106+18x 106 18x △m=18x
m(Na2CO3·xH2O) m(Na2CO3) △m=7.2g
m(Na2CO3)=B-A=A=5.3g (1分)
∴m(Na2CO3·xH2O)=12.5g (2分) x=8 (2分) 答:略