高一化学同步测试—极性分子、非极性分子
一、选择题(共6小题,每小题3分,共18分。只有1个正确答案)
1.用带静电的有机玻璃棒靠近下列液体的细流,细流发生偏转的是 ( )
A.苯 B.二硫化碳 C.溴水 D.四氯化碳
2.下列物质中,以极性键结合的非极性分子是 ( )
A.H2S B.CO2 C.SO2 D.H2O
3.下列分子中,键的极性最强的是 ( )
A.AsH3 B.H2Se C.HBr D.HI
4.下列物质中不含非极性共价键的是:①Na2O2 ②CCl4 ③FeS2 ④NH4Cl
⑤H—O—O—H⑥Ca(OH)2 ( )
A.①②③④ B.④⑤⑥ C.②④⑥ D.②③⑤
5.碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为 ( )
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
6.下列分子中,含有非极性键的化合物是 ( )
A.HD B.CO2 C.H2O D.C2H5OH
二、选择题(共10小题,每小题3分,共30分。有1-2个答案)
7.下列各组物质中,化学键的类型(离子键、共价键)相同的是 ( )
A.CaO和MgCl2 B.NH4F和NaF
C.Na2O2和H2O2 D.H2O和SO2
8.下列叙述正确的是 ( )
A.由极性键结合而成的分子一定是极性分子
B.非极性键只存在于双原子单质分子里
C.非极性分子中,一定含有非极性键
D.一般情况下,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂
9.下列含有极性键的非极性分子是 ( )
(1)BF3 (2)NH3 (3)CH4 (4)CO2 (5)N2 (6)H2S (7)SO2
(8)CS2 (9)H2O (10)HF (11)CCl4 (12)SiO2
A.(2)(3)(4)(5)(8) B.(1)(3)(4)(5)(8)(11)
C.(1)(3)(4)(8)(11) D.以上均不对
10.下列叙述中正确的是 ( )
A.同主族金属元素的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越高
C.分子间作用力越弱的分子其熔点越低
D.同周期元素的原子半径越小越易失去电子
11.CO、BF3、CCl4、CH4都是非极性分子,而NH3、H2、H2O都是极性分子。由此推出
ABn型分子是非极性分子的经验规律正确的是 ( )
A.所有原子在同一平面内
B.分子中不含氢原子
C.A的原子量小于B
D.在ABn分子中A原子化合价的绝对值等于其最外层电子数
12.下列叙述正确的是 ( )
A.非金属元素的原子不能构成离子化合物
B.共价化合物分子中一定不含离子键
C.非极性键只存在于双原子分子的单质中
D.不同元素组成的多原子分子一定是极性分子
13.下列说法中,正确的是 ( )
A.由分子构成的物质中一定含有共价键
B.离子化合物中一定含有非金属元素
C.正四面体结构的分子中的键角一定是109°28′
D.不同的原子的化学性质可能相同
14.实验测得BeCl2为共价化合物,两个Be——Cl键间的夹角为180°,由此可判断BeCl2
属于 ( )
A.由极性键形成的极性分子 B.由极性键形成的非极性分子
C.由非极性键形成的极性分子 D.由非极性键形成的非极性分子
15.下列说法正确的是 ( )
A.金属元素的最高价氧化物的水化物一定是碱
B.原子形成的共价键数目,一定等于该原子所含有的未成对电子数目
C.由双原子组成的单质分子,一定是非极性分子
D.非金属元素相互化合而成的化合物一定是共价化合物
16.NCl3是一种淡黄色油状液体,测定其分子具有三角锥形结构,下列对NCl3的有关描述
正确的是 ( )
A.它是一种非极性分子
B.分子中存在非极性共价键
C.其挥发性比PCl3大
D.已知NBr3对光很敏感,故NCl3也具有光敏性
三、填空题
17.通常碘在水、酒精等溶剂中呈棕色,而在苯、四氯化碳等溶剂中呈紫色,试推测碘分别在二硫化碳和氯仿(CHCl3)中的可能颜色。在CS2中 ,在氯仿中 。
18.溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是 ,它是由 键形成的 化合物。
(2)溴化碘和金属镁反应生成物属于 化合物,电子式 。
(3)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 它
是由 键形成的 化合物。
19.在下列H2O、H2O2、Ba(OH)2、Na2O2、K2O等化合物中,由离子键和极性键构成的
化合物是 ;由离子键和非极性键构成的化合物是 ;由
极性键和非极性键构成的化合物是 。
20.硫化氢(H2S)分子中,两个H—S键的平角接近90°,说明H2S分子的空间构型
为 ;二氧化碳(CO2)分子中,两个C=O键的夹角是180°,说
明CO2分子的空间构型为 ;甲烷(CH4)分子中,两个相邻C—H键
的夹角是109°28′,说明CH4分子的空间构型为 。
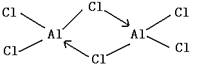
21.已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃常压即开始升华。
(1)氯化铝是 晶体(填“离子”或“分子”)。
(2)在500℃,1.01×105Pa时,氯化铝的蒸气密度(换算成标准状况)为11.92g·L-1,
且已知它的结构中还含有配位键,氯化铝的化学式为 。
(3)设计一个更可靠的实验,证明氯化铝是离子晶体还是分子晶体,你的实验是
。
22.A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次
递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比
K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。它们的元素符号分
别为:A ;B ;C ;B原子的结构示意
图为 ;BC2是由 键组成的 (填“极性”或“非
极性”)分子。
23.A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原
子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种
元素能结合成化合物C2AB3,在1 mol C2AB3中共有52mol电子,D元素的单质0.5mol
与酸全部反应时,有9.03×1023个电子转移,在B与D形成的化合物,D的质量分数
为52.94%,D原子核内有14个中子,每个E原子与氢原子化合时只生成了一个共价单
键。试填写下列空白。
(1)这五种元素的名称
A B C D E
(2)A与B形成的高价化合物属于 分子(填“极性”、“非极性”)
(3)C在B中燃烧生成的化合物中化学键有 键和 键(填离
子、极性、非极性)
(4)A、B、C结合成的化合物的化学式是 。
参 考 答 案
一、选择题1.C 2.B 3.C 4.C 5.D 6.D
二、选择题7.AD 8.D 9.C 10.BC 11.D 12.B 13.BD 14.B 15.C 16.CD
|
|
|
18.(1) ;极性;共价(2)离子; (3) ;极性;共价
19.Ba(OH)2 ; Na2O2; H2O2 20 .折线型; 直线型;正四面体型
|
(2)
|
分子晶体。
22.H; C; S; ;极性;非极性
23.(1)碳;氧;钠;铝;氯 (2)非极性 (3)离子;非极性 (4)Na2CO3
批注:北京英才苑专家组 吕寅审定
练习注重基础的巩固,针对性好,适用新授课后的练习,21难度较大。