高一化学同步测试(5)—《碱金属元素》
一、选择题(每小题3分,共10题,计30分,每小题只有一个正确答案)
1.下列关于碱金属叙述中正确的是 ( )
A.原子的最外层电子数都为1,次外层电子数都为8
B.单质的化学性质活泼,易失电子发生氧化反应
C.除锂外均以化合态存在于自然界中
D.单质的密度都小于1
2.钠和锂有相似的化学性质,下列说法中能较好地解释这个事实的是 ( )
A.都是金属元素 B.原子半径相差不大
C.最外层电子数相同 D.化合价相同
3.下列物品的盛放错误的是 ( )
A.过氧化钾固体必须密封保存 B.烧碱必须密封保存
C.碱金属必须保存在煤油中 D.氢氧化钠溶液用带橡胶塞的玻璃瓶盛放
4.在空气或氧气中加热,主要生成碱性氧化物的是 ( )
A.Li B.Na C.K D.Rb
5.下列物质与水反应最剧烈的是 ( )
A.Li B.Na C.K D.Rb
6.以下关于铷的叙述,不正确的是 ( )
①铷的密度比钠大,熔点比钠高 ②与冷水不反应,与热水反应放出氢气
③铷盐大多数都易溶于水 ④铷的原子半径和离子半径都分别比钠大
A.①② B.②③ C.③④ D.①④
7.焰色反应指的是 ( )
A.可燃物质在燃烧时其火焰表现出的颜色
B.是一种检验各种元素普遍应用的一种方法
C.一部分金属及其化合物在无色火焰上燃烧时火焰呈现出的特征颜色
D.把一些金属的盐溶液放在火焰上加热
8.下列关于铯的叙述正确的是 ( )
A.硫酸铯是一种难溶性离子化合物
B.碳酸氢铯加热能迅速分解,碳酸铯受热不分解
C.铯能在氧气中燃烧生成氧化铯
D.在自然界中有少量游离态的铯存在
9.合金有许多特点,如Na—K合金为液体,而Na和K的单质均为固体。据此试推测:生
铁、纯铁、碳三种物质中,熔点最低的是 ( )
A.纯铁 B.生铁 C.碳 D.无法确定
10.下列对碱金属性质的叙述中,正确的是 ( )
A.单质都是银白色的柔软金属,密度都较小
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水剧烈反应生成碱和氢气
D.单质的熔、沸点随着原子序数的增加而升高
二、选择题:(每小题有1—2个答案,每小题4分,共20分)
11.下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是 ( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物
12.工业上常用氨碱法制取碳酸钠(将氨和二氧化钠先后通入饱和食盐水而析出小苏打,再
经过滤、焙烧,得到纯碱),但却不能用氨碱法制碳酸钾,这是因为在溶液中( )
A.KHCO3溶解度较大 B.KHCO3溶解度较小
C.K2CO3溶解度较大 D.K2CO3溶解度较小
13.在一定温度下,向某饱和硫酸钠溶液中加入ag无水Na2SO4粉末,搅拌、静置后,析出
bgNa2SO4·10H2O晶体。下列量中,可以根据已知条件计算的是 ( )
①该温度下硫酸钠的溶解度 ②原饱和溶液减少的水的质量
③原饱和溶液减少的溶质的质量 ④析出晶体中含Na2SO4的质量
A.①③ B.③④ C.②④ D.全部
14.①钾比水轻;②钾的熔点较低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱
性。某学生将一小块金属钾投入滴有酚酞试液的水中,以上实验能证明上述四点性质中
的 ( )
A.①④ B.①②④ C.①③④ D.①②③④
15.在天平两边各放一个相同质量的烧杯,分别加入100gH2O,向左盘烧杯中加入4.6g金属
钠,为了保持天平指针指向零点,应向右盘加入金属钾的质量为 ( )
A.3.90g B.4.52g C.5.12g D.7.80g
三、填空题:
16.(12分)根据草木灰中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品;②溶解、沉淀;③_________;④____ __;
⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示:_____ ___
(选择A.B.C.D填空)。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,其原因是_________________。
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,其主要目的是为了防止
___________ ______。
(5)所得产物中,主要钾盐有:___________等。
17.(8分)有A.B.C.d四瓶未知溶液,它们是KCl、HCl、KOH和酚酞,有人不用任何
试剂就能把它们一一鉴别出来,其实验步骤如下:
①取少许溶液两两混合,据此把四种溶液分成两组。
②取一组混合溶液,不断滴入另一组中的一种未知溶液,据此鉴别出a和b。
③再取2mL已鉴别出的a溶液,滴入3滴未知溶液c,再加入4mL未知溶液d,在这个
过程中无明显变化。
综上实验可以确认a是___________,b是____________,c是__________,d是__________。
18.(4分)回答下列问题:
(1)氢氧化钠固体或溶液为什么要保存在密闭容器里?
(2)钠和钾的外观很相似,怎样来鉴别它们?
19.(4分)用离子方程式表示除去下列括号内的杂质的反应:
(1)CO2(HCl):____________ __________________________
(2)NaCl(Na2CO3)(均是溶液)____________________________
(3)NaOH(Na2CO3)_____________________________________
(4)NaHCO3(Na2CO3)___________________________________
20.(4分)有A.B.C.D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg+、Cu2+,
阴离子是Cl-、OH-、NO、SO(每种离子只能用一次),现将溶液两两混合,记录现象
如下:A+B→白色沉淀 B+D→白色沉淀 C+D→蓝色沉淀
则A.B.C.D的化学式分别是_________、___________、__________、__________。
21.(6分)苏打和小苏打有着广泛的应用。试从消耗反应物的量等角度,回答下列问题:
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用_____ _____,
因为_______________ ______________。
(2)用于洗涤餐具及实验室的玻璃仪器等,选用______ _____,因为_______ ____
____________ _________________________。
(3)胃溃疡(胃壁溃烂或穿孔)病人的胃酸过多,医生给服用Al(OH)3胶乳,既不用苏
打也不用小苏打,是因为__________________________________________。
四、计算题:(共12分)
22.(6分)将10g碳酸钠和碳酸氢钠的混合物同足量的盐酸反应后,所生成的气体被烧碱溶
液完全吸收,烧碱溶液增重4.4g,求混合物中碳酸钠的质量分数。
23.(6分)向100g8%的NaOH溶液中通入CO2生成的盐的质量为13.7g时,求固体盐的成
份。
五、《碱金属元素》答案
一、选择题:
1、B 2、C 3、C 4、A 5、D 6、A 7、C 8、B 9、B 10、C
二、选择题:11、B 12、A 13、D 14、D 15、B
三、填空题:
16、(1)过滤,加热蒸发 (2)B (3)得到的滤液浑浊
(4)变热不均匀,液体飞溅 (5)K2CO3 KCl K2SO4
17、a、HCl b、KCl c、KOH d、酚酞
18、(1)NaOH易潮解且与CO2反应 (2)投入水中,反应激烈的是K
19、(1)H++HCO==H2O+CO2↑ (2)CO+Ba2+==BaCO3↓
(3)CO+Ca2+==CaCO3↓ (4)CO+CO2+H2O==2HCO
20、MgCl2 AgNO3 NaOH CuSO4
21、Na2CO3 碱性强,耗量少
Na2CO3 碱性强
产生CO2加重溃疡
四、计算题:
22、解:设Na2CO3质量为x NaHCO3质量为y
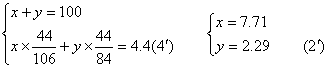 ∴Na2CO3%=77.1%
∴Na2CO3%=77.1%
答:略
23、解:m(NaOH)=8g
NaOH全部变为Na2CO3时 m(Na2CO3)=10.6g
NaOH全部变为NaHCO3时 m(NaHCO3)=16.8g
∵10.6<13.7<16.8 ∴盐为Na2CO3 、NaHCO3的混合物