高一化学期末综合测试题(三)
一、选择题
1.下列气体中既能用浓硫酸干燥,又能用碱石灰干燥的是 ( )
A.Cl2 B.CO C.HCl D.SO2
2.下列物质中,能通过单质之间直接化合的是 ( )
A.SO3 B.FeCl2 C.CuS D.Na2O2
3.同时除去混在CO2气体中杂质HCl 和SO2,应选择的试剂是 ( )
A.苛性钠 B.纯碱 C.小苏打 D.碱石灰
4.能保存在有磨口玻璃塞的无色试剂瓶中的物质是 ( )
A.硝酸银 B.浓盐酸 C.浓硝酸 D.浓烧碱
5.下列各物质的电子式正确的是 ( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() A.H+[∶Br∶] – B.K+Cl –
A.H+[∶Br∶] – B.K+Cl –
C.Na+[∶O∶H] – D.Na+∶O∶O∶Na+
6.下列说法正确的是 ( )
A.离子型化合物中一定无共价键 B.共价化合物中一定无离子键
C.极性分子中一定无非极性键 D.非极性分子中一定无极性键
7.铜有两种天然同位素,63Cu 和65Cu 。已知铜元素的平均原子相对质量为63.5,则159 g CuO中含63Cu的物质的量为 ( )
A.0.25mol B.0.5mol C.0.75mol D.1.5mol
8.原子核内中子数为N 的R2+离子,质量数为A,则n g该元素的氧化物中所含质子数的物质的量为 ( )
![]()
![]()
![]() A. B.
A. B.
![]() C. D.
C. D.
9.向紫色石蕊溶液中加入足量的Na2O2粉末,充分搅拌,最后溶液的颜色是 ( )
A.红色 B.蓝色 C.紫色 D.无色
10.用NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.在常温常压下,11.2升氮气含有的原子数为0.5NA
B.在常温常压下,4.0g氦气含有的原子数为NA
C.32g臭氧(O3)所含原子数为2NA
D.在同温同压时,相同体积的任何气体单质所含的原子数目相同
11.下列离子方程式书写不正确的是 ( )
A.硫化亚铁跟稀硫酸反应: S2 – + 2H+ ==== H2S↑
B.氯化钡溶液跟硫酸铜溶液反应: Ba2+ + SO42– ==== BaSO4↓
C.氯气通人氢氧化钠溶液中: Cl2 + 2OH– ==== Cl– + ClO– + H2O
D.过氧化钠和水反应: 2Na2O2 + 2H2O ==== 4Na+ + 4OH– + O2↑
12.用0.1 mol/L Na2SO3溶液30 mL,恰好将2×10 –3 mol的XO4–离子还原,则元素X在还原产物中化合价是 ( )
A.+1 B.+2 C.+3 D.+4
13.用1 L 1.0 mol/L NaOH溶液吸收0.8 mol CO2,所得溶液中CO32–和HCO3–的物质的量浓度之比约是 ( )
A.1∶3 B.2∶1 C.2∶3 D.3∶2
14.氢化钠NaH是一种白色的离子化合物,其中钠是+1价,NaH跟水反应放出氢气。下列关于NaH的叙述中正确的是 ( )
A.NaH在水中显酸性 B.NaH中氢离子半径比锂离子半径小
C.NaH中氢离子可被还原成氢气 D.NaH放入水中或盐酸中都产生氢气
15.下列各组微粒具有相同质子数和电子数的是 ( )
A.CH4、NH3、Na+ B.OH–、F–、NH3
C.H3O+、NH4+、H2F+ D.O2–、NH2–、CH3–
16.A元素的阳离子,B元素的阳离子和C元素的阴离子都具有相同的电子层结构,A的阳离子半径大于B的阳离子半径,则A、B、C三种元素的原子序数的大小应符合
A.A <B <C B.B <C <A ( )
C.B <A <C D.C <A <B
17.50mL18.0mol/L硫酸溶液中加入足量的铜片并加热,被还原的硫酸的物质的量
A.等于0.45mol B.小于0.45mol ( )
C.大于0.45mol,小于0.9mol D.等于0.9mol
18.在强碱性的溶液中,下列各组离子能够大量共存的是 ( )
A.Na+、Cu2+、NO3–、SO42+ B.Na+、K+、Cl–、HCO3–
C.Ba2+、Na+、NO3–、Cl– D.K+、Na+、CO32–、HSO4–
19.某溶液中Cl –、Br –、I – 三者物质的量之比为2∶3∶4,要使溶液中的Cl –、Br –、I –物质的量之比变为4∶3∶2,则加入Cl2的物质的量是原溶液中I – 物质的量的 ( )
![]()
![]()
![]()
![]() A. B. C. D.
A. B. C. D.
20.有一硫化钠、亚硫酸钠、硫酸钠的混合物。经测定含硫的质量分数为25.6%,则此混合物中含氧的质量分数为 ( )
A.37.6% B.36.8% C.51.2% D.无法计算
21.金属钠、氧化钠、过氧化钠的混合物共3.72 g,使其与足量水反应,生成672 mL(标准状况)气体,该混合物点燃时恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为 ( )
A.1∶1∶1 B.2∶2∶1 C.3∶2∶1 D.2∶1∶1
22.9 g某单质A与11.2 L(标准状况)氯气在一定条件下恰好完全反应,则单质A可能是 ( )
A.Na B.Al C.Fe D.P
23.在密闭容器中盛有H2、O2、Cl2的混合气体,点燃后三种气体恰好反应,所得溶液中溶质的质量分数为28.9%,则原容器中H2、O2、Cl2三种气体的体积比为 ( )
A.9∶4∶1 B.9∶4∶2 C.11∶5∶2 D.11∶5∶1
24.有甲、乙、丙三份等体积、等物质的量浓度的NaOH溶液。若将甲溶液蒸发掉一半水(无晶体析出),在乙中通入少量CO2,丙不变。然后用同浓度的盐酸溶液分别中和,完全反应后,所需盐酸溶液的体积关系是 ( )
A.甲=丙>乙 B.丙>乙>甲
C.乙>丙>甲 D.甲=乙=丙
![]() 25.在标准状况下,V L NH3气溶于1 L水中,所得溶液的密度为ρg/cm3,则此氨水的物质的量浓度是 ( )
25.在标准状况下,V L NH3气溶于1 L水中,所得溶液的密度为ρg/cm3,则此氨水的物质的量浓度是 ( )
![]() A. V mol/L
B. mol/L
A. V mol/L
B. mol/L
![]()
![]()
C. mol/L D. mol/L
二、填空题
26.物质的量相等的KI、Na2S、FeBr2溶于水后配成三种溶液,分别与Cl2反应,生成I2、S、FeCl3和Br2,若三个反应中消耗Cl2的物质的量相等,则消耗KI、Na2S、FeBr2三种物质的物质的量之比为————。
27.下图为元素周期表中短周期的一部分,B、C两种元素原子的核外电子数之和等于A原子质量数的2倍还多3,A原子核内质子数和中子数相等。请回答:
| A | |||
| B | C |
⑴元素名称A______,B______,C______。
⑵A的气态氢化物电子式__________,它属于______键(极性、非极性)结合的分子,在空间分子构型是________型。属于________分子(极性、非极性)。
⑶B的最高价氧化物和对应水化物的化学式分别是____________________,有关二者相互转化反应的化学方程式是______________________________。
28.A、B、C、D四种化合物,其焰色反应均为浅紫色。A、B、C和盐酸反应都可得到D;B、C以等物质的量在溶液中反应可得到A;若在B溶液中通入一种无色无味的气体,适量时得到A,过量时得C。则A为________,B为________,C为________,D为________。有关反应的离子方程式有:
________________________________________
________________________________________
________________________________________
________________________________________
三、实验题
29.下列是甲、乙、丙三位同学各自设计的实验,并根据实验现象,每人都得出自己的试样中含有SO42–的结论。
学生甲的实验过程:
学生乙的实验过程:
学生丙的实验过程:
⑴你认为学生甲的实验是否严谨?________(填写“严谨”、“不严谨”),原因是________________________________________。
⑵你认为学生乙的实验是否严谨?________(填写“严谨”、“不严谨”),原因是________________________________________。
⑶如果学生丙的实验方案是正确的,那么试液①是________,现象A为________;试剂②是________,现象B为________。
30.⑴写出浓硫酸与木炭粉在加热条件下反应的化学方程式____________________。
⑵试用下图中所列各种装置设计一个实验来验证上述反应所产生的各种产物。
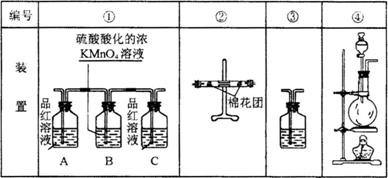
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置编号):_____ →
______ → ______ → ______。
⑶实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是____________________,B瓶溶液的作用是____________________,C瓶溶液的作用是____________________。
⑷装置②中所加固体药品是________,可确证的产物是________,确定装置②在整套装置中位置的理由是____________________。
⑸装置③中所盛溶液是____________,可验证的产物是________。
四、计算题
31.用8.7 g MnO2和10 mol/L的盐酸120 mL反应制取Cl2。问⑴在标准状况下可生成多少升Cl2?⑵把反应后溶液稀释至1 L后取出20 mL(不考虑HCl损失),在20 mL的溶液中加入足量AgNO3,可制得AgCl沉淀多少克?
32.有一Na2O2和NaHCO3的均匀混合物粉末,将其等质量分为两份,其中一份加入100毫升盐酸使其充分反应后,溶液呈中性,放出气体2.24 L(标准状况);将上述气体通入另一份混合物中充分反应后,气体体积变为2.016 L(标准状况)。求原混合物中Na2O2和NaHCO3的物质的量之比及加入盐酸的物质的量浓度各是多少?
参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | B | D | C | B | C | B | D | B | D | C | A | D | A |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | D | C | D | B | C | C | A | D | B | D | D | C |
二、填空题
26.6∶3∶2
27.⑴ A:氮;B:硅;C:氯
![]()
|
⑶SiO2,H2SiO3或H4SiO4,H2SiO3 ===== H2O + SiO2
28.A:K2CO3;B:KOH;C:KHCO3;D:KCl
⑴ CO32– + 2H+ ==== H2O + CO2↑
OH– + H+ ==== H2O
HCO3– + H+ ==== H2O + CO2↑
⑵ HCO3– + OH– ==== CO32– + H2O
⑶ 2OH– + CO2 ==== CO32– + H2O
三、实验题
29.⑴ 不严谨,试液A可能含有Ag+干扰;
⑵ 不严谨,试液B中可能有SO32–干扰
|
30.⑴ C + 2H2SO4(浓) ==== 2H2O + CO2↑+ 2SO2↑
⑵ ④→ ② → ① → ③
⑶ 检验产物气体中含有SO2;将SO2全部氧化而吸收,确定气体中SO2已被B瓶溶液全部氧化
⑷ 无水CuSO4粉末,水蒸气,由于生成的气体经过①、③时会有水蒸气带出,所以②一定要在①、③之前
⑸ 澄清石灰水,CO2
四、计算题
31.⑴ 2.24 L ⑵ 2.87 g
32.8∶1,3.4mol/L;2∶9,1.3 mol/L