高一化学期末综合练习
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 C1 35.5 P 31
一、选择题(本题包括20小题,每小题4分,共80分。每小题只有一个选项符合题意)
1.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.![]() 原子核内含有4个质子 D.
原子核内含有4个质子 D.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子D.
原子核内含有3个中子D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
2.下列各项中表达正确的是
![]()
![]()
A.F—的结构示意图: B.CO2的分子模型示意图:
![]() C.NaCl的电子式:
D.N2的结构式: :N≡N:
C.NaCl的电子式:
D.N2的结构式: :N≡N:
3.下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
4.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
5.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
6.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
7.下列实验操作正确的是D
A.将氢氧化钠固体放在滤纸上称量 B.用10mL量筒量取8.58mL蒸馏水
C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集
D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
8.能与人体血液中血红蛋白结合的一种有毒气体是
A.氯气 B.氮气 C.一氧化碳 D.甲烷
9.下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
10.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
A.Ds原子的电子层数为7 B.Ds是超铀元素
C.Ds原子的质量数为110 D.Ds为金属元素
11.巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3C00—、Cl— B.Mg2+、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
12.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法正确的是
A.KClO3在反应中失去电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1 molKClO3参加反应有2mol电子转移
13.下列说法不正确的是
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
14.下列离子方程式正确的是
A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.钠与水反应Na+2H2O=Na++2OH-+H2↑
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
15.常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO B.(NH4)2SO4 K2SO4 NH4Cl
C.AgNO3 KNO3 Na2CO3 D.Na2CO3 NaHCO3 K2CO3
16.下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
17.下列有碱金性铷(Rb)的叙述中,正确的是
A、灼烧氯化铷时,火焰没有特殊颜色 B、硝酸铷是离子化合物,易溶于水
C、在钠、钾、铷三种单质中,铷的熔点最高 D、氢氧化铷是弱碱
18.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是
A、WX4是沼气的主要成分 B、固态X2Y是分子晶体
C、ZW是原子晶体 D、ZY2的水溶液俗称“水玻璃”
19.已知KMnO4与浓HCl在常温下反应能产生Cl2.若用图2所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应.每个虚线框表示一个单元装置,其中错误的是
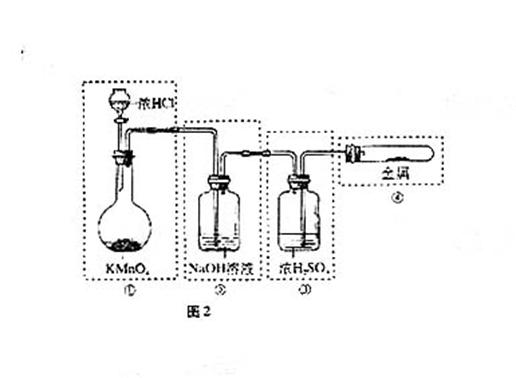 A. 只有①和②处
B. 只有②处
A. 只有①和②处
B. 只有②处
C.只有②和③处 D. 只有②、③、④处
20.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B. Cu C. Ag D. H2
姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
二、填空题:(共26分)
21.(8分)请按要求填空:
(1)用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为: 。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为: 、蒸发、结晶、 。
(3)除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式): 。
22.(6分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 、 。
23.(12分)右表是元素周期表的一部分。
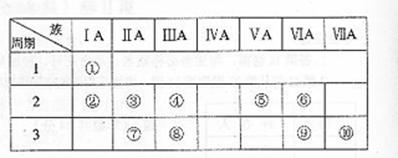
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的最外层电子数是次外层电子数两倍加1,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有共同的元素是
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
三、实验题:(共10分)
24.(10分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
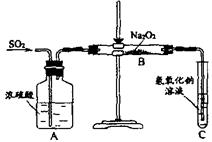
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:


![]()


上述方案是否合理? 。请简要说明两点理由:
① ;② 。
四、推断题:(共16分)
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | ― | ↓ | ↓ | ↓ | |
| D | - | ↓ | - | ↓ | ↓ | ↓ | |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
25.(16分)有A、B、C、D、E、F、G7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba (OH )2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。试回答下面问题。
⑴A的化学式是 ,G的化学式是 。判断理由是
。
⑵写出其余几种物质的化学式。B: ,C: ,D: ,E: ,F: 。
五、(本题共18分)
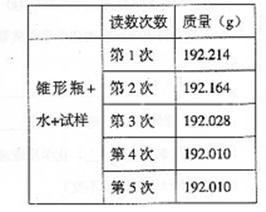
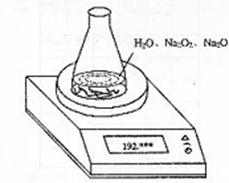 26.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
26.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
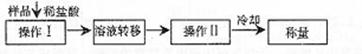
①操作Ⅱ的名称是
②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。
答案:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | A | A | D | A | C | D | C | B | C | D | C | D | D | D | C | B | D | D | C |
二、21.(8分) ⑴(3分)100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管 ⑵(2分)溶解 过滤 (3)(3分)BaCl2[或Ba(OH)2]、K2CO3、HCl
22.(6分)(1)N2 CO; CO2 N2O (2)SO2、 O3
23(12分)(1)(2分)HCl 弱 (2)(3分)N ![]() (3)(3分)H、O、S (4)(4分)Be(OH)2+2NaOH=Na2BeO2+2H2O
Li)
(3)(3分)H、O、S (4)(4分)Be(OH)2+2NaOH=Na2BeO2+2H2O
Li)
24.(10分)(1)2Na2O2+2SO2=2Na2SO3+O2 (2)取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根)
25.(16分) ⑴KCl,AgNO3。混合时只生成一种沉淀的是KCl,生成的是AgCl,所以A是KCl,G是AgNO3。⑵B:Na2SO4 C:MgCl2 D:Na2CO3 E:Ca(NO3)2 F:Ba(OH)2
26.(18分)(1)(2分)2Na2O2+2H2O=4NaOH+O2↑
(2)(8分)试样质量 锥形瓶加水的质量 第4(或5)次读数(或用具体数值表示) 锥形瓶内质量已达恒重
(3)(8分)①蒸发 ②NaCl的质量 ③烧杯 玻璃棒 ④偏大