高一化学第一学期期末联考
化 学 试 卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分,考试时间100分钟。
第Ⅰ卷(选择题 共68分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)
1.漂粉精的有效成分是 ( )
A.CaCl2 B.Ca(ClO)2 C.CaCO3 D.Ca(OH)2
2.生活用食盐必须是国家统一标准的“碘盐”,下列关于“碘盐”的叙述正确的是( )
A.“碘盐”就是“I2+NaCl” B.“碘盐”就是食盐中加入适量的KIO3
C.“碘盐”就是NaI D.“碘盐”中含碘越多越好
3.物质灼烧时,火焰呈紫色的一定含有 ( )
A.钾原子 B.钾离子 C.钾元素 D.钾的化合物
4.下列标记,不需要在容量瓶上标有的是 ( )
A.标线 B.温度 C.浓度 D.容量
5.宣传科学知识,揭露伪科学是科学工作者和青少年学生的权利和义务。下列各项叙述在
科学性上没有错误的是 ( )
A.用特殊的催化剂可将水变成石油
B.溴化银可用于人工降雨
C.这种饮料不含任何化学物质,绝对纯净
D.煤的气化和液化是高效、清洁地利用煤炭的重要途径
6.1 mol H2和32g O2相比较,前者与后者的体积大小关系是 ( )
A.前者大 B.后者大 C.相等 D.无法确定
7.下列说法正确的是 ( )
A.化学反应中的能量可以在不同条件下转化为热能、电能等
B.反应物的总能量高于生成物的总能量时发生吸热反应
C.Ba(OH)2·8H2O与NH4Cl的反应是放热反应
D.木炭在氧气中的燃烧是吸热反应
8.下列反应需要加入氧化剂才能实现的 ( )
A.Cl2→Cl- B.K→K+ C.CO2→CO32- D.SO3→SO42-
二、选择题(本题包括11小题,每小题4分,共44分,每小题有一个或两个选项符合题意。
若该小题只有一个正确答案,多选为0分,若该小题有两个选项符合题意,只选一个且
正确的为2分,但只要选错一个就为0分)
9.在含有溴化钾和碘化钾的混合溶液里通入过量氯气,然后把此溶液蒸干,灼烧;得到的
固体物质是 ( )
A.KCl B.KCl和KBr C.I2 D.Br2
10.下列叙述中正确的是 ( )
A.1 mol任何物质都含有约6.02×1023个原子
B.硫酸的摩尔质量是98g
C.1 mol氮气的质量是28g
D.摩尔是国际单位制中七个基本物理量之一
11.下列叙述正确的是 ( )
A.随着核电荷数的增加,碱金属单质密度逐渐减小
B.碱金属单质的熔、沸点变化规律与卤素单质相同
C.碱金属都能与水反应放出H2
D.随着核电荷数的增加,卤素单质的氧化性逐渐减弱
12.根据下列反应:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+ 判断离子的还原性
由强到弱的顺序是 ( )
A.Br->Fe2+>I- B.I->Fe2+>Br-
C.Br->I->Fe2+ D.Fe2+>I->Br-
13.在酸性的无色透明溶液中,能大量共存的离子组是 ( )
A.Ba2+、Ag+、NO3-、Cl- B.Mg2+、NH4+、NO3-、Cl-
C.HCO3-、K+、SO42-、Cl- D.K+、Cu2+、NO3-、MnO4-
14.与离子方程式H++OH-=H2O相对应的化学方程式是 ( )
A.Ba(OH)2+2HCl=BaCl2+2H2O
B.NaOH+NaHSO4=Na2SO4+H2O
C.Ba(OH)2+H2SO4=BaSO4↓+2H2O
D.NaOH+CH3COOH=CH3COONa+H2O
15.设NA为阿伏伽德罗常数的值,下列说法正确的是 ( )
A.1molNa+含有的电子数为11NA
B.标准状况下,11.2L H2与氦气所含原子数都是NA
C.4g金属钙变成钙离子时失去的电子数为0.1NA
D.1mol CO2的质量与NA个CO2分子的质量之和相等
16.若用胆矾(CuSO4·5H2O)配制0.1mol·L-1的硫酸铜溶液,其正确的操作是 ( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水里
B.称取胆矾25g,溶解在1L水里
C.将25g胆矾溶于水,然后将此溶液稀释至1L
D.将16g胆矾溶于水,然后将此溶液稀释至1L
17.NaHCO3和Na2CO3·10H2O的混合固体10g,当配成20mL溶液时,c(Na+)=0.5mol/L;
如果将该10g混合固体加热至恒量,最后的固体质量是 ( )
A.4.7g B.5.3g C.4.2g D.8.5g
18.下列各物质属于非电解质的是 ( )
①NaOH ②蔗糖 ③铜 ④Na2CO3 ⑤酒精 ⑥CaO
⑦CO2 ⑧CH3COOH ⑨氯水 ⑩CaCO3
A.②⑤⑦ B.②③⑤⑦ C.②③⑦⑩ D.②⑦⑧⑨
19.在体积为VmL密度为ρg/cm3的溶液中,含有式量为M的溶质mg,其物质的量浓度为
c mol/L,溶质量分数为ω%,下列表示式中正确的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
第Ⅱ卷(非选择题,共52分)
三、填空题(本题包括2小题,共12分)
20.(3分)下列说法正确的是
A 氯水应该保存在无色的细口玻璃瓶中。
B 金属钠应该保存在煤油中。
C 分离碘和沙子的混合物可选用升华法。
D 液溴应该保存在棕色试剂瓶中,并加少量水,减少其挥发。
E 在碘水中加入适量的CCl4,振荡静置后,上层溶液应该为紫红色。
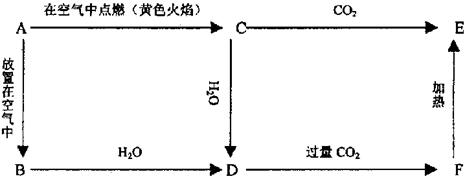
21.(9分)如下图所示,A为银白色金属,C为淡黄色的固体,A、B、C、D、E、F中均含
同一种元素。
|
(1)写出C、D、F的化学式C ,D ,F 。
(2)A与水反应的离子方程式 。
四、实验题(本题包括2小题,共26分)
22.(6分)已知土豆中含有淀粉。某同学在进行研究性学习的过程中,把碘酒滴到土豆片上,
发现有蓝色出现。请问。
(1)如果想要进一步确定碘酒中何种物质遇土豆片显蓝色,你认为还应该做一个什么实
验。(简要填写实验步骤与现象)
(2)从上述的实验中可以得出的结论是
。
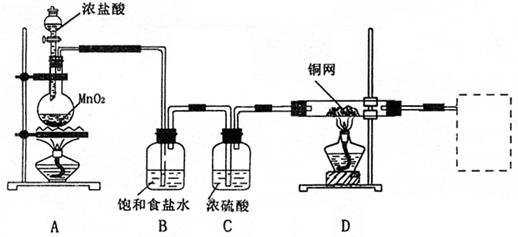
|
(1)写出A中发生反应的离子方程式 。
(2)上图中B、C两个装置能否调换位置 (填“能”与“不能”),原因是
。
(3)对于A、D两处的酒精灯,应该先点燃 ;原因是
。
|
该反应的化学方程式 。
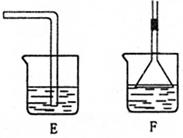
(5)为了吸收尾气,最好选择右图中的 装置
(填写对应字母)。
(6)假定上述尾气吸收的溶液为NaOH,请写出其离子
方程式 。
五、计算题(本题包括2小题,共14分)
24.(6分)现在Na2CO3和NaCl固体混合物22.3g,完全溶于水后,加入足量的AgNO3溶液,
得到一定量的白色沉淀,用过量的称HNO3处理该白色沉淀,得到标况下的气体2.24L,
计算原混合物固体中NaCl的质量。
25.(8分)在标况下,将6.72L的CO2气体通过一定量的Na2O2气体通过一定量的Na2O2后,
收集到4.48L的气体;又将充分反应后的固体溶于水,得到200mL的溶液。请计算:
(1)4.48L气体的质量。
(2)最终溶液中Na+的物质的量浓度。
高一第一学期期末联考
化学试卷参考答案
一、选择题(每小题3分,共24分)
1.B 2.B 3.C 4.C 5.D 6.D 7.A 8.B
二、选择题(本题包括11小题,每小题4分,共44分,每小题有一个或两个选项符合题意。
若该小题只有一个正确答案,多选为0分,若该小题有两个选项符合题意,只选一个且
正确的为2分,但只要选错一个就为0分)
9.A 10.C 11.CD 12.B 13.B 14.AB 15.D 16.C 17.B 18.A 19.BD
三、填空题(12分)
20.(3分)BCD(答对1个给1分,如果有错选得0分)
21.(9分)(1)C: Na2O2 D:NaOH F:NaHCO3(各2分)
(2)2Na+2H2O=2Na++2OH-+H2↑ (3分)
四、实验题:(26分)
22.(6分)(1)另取酒精滴到土豆片上,没有明显现象出现(3分)(2)碘单质遇淀粉
|
23.(20分)(1)MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O(3分)
(2)不能(2分);最终水蒸气无法除去(2分)
|
(4)棕黄色烟(2分); Cu+Cl2 CuCl2
(2分)
(5)F (2分) (6)Cl2+2OH-+Cl-+ClO-+H2O(3分)
五、计算题(共14分)
24.(6分)解:由题意得,白色沉淀为AgCl和Ag2CO3混合物,其中Ag2CO3能溶于稀
HNO3,产生CO2
n(Na2CO3)=n(Ag2CO3)=n(CO2)=2.24l/22.4l·mol-1=0.1mol (3分)
m(Na2CO3)=0.1mol×106g·mol-1=10.6g
m(NaCl)=22.3g-10.6g=11.7g
答:混合物固体中NaCl的质量为11.7g (3分)
25.(8分)2Na2O2 + 2CO2 = 2Na2CO3 + O2 △V
2×22.4L 2mol 22.4L 22.4L
4.48L 0.2mol 2.24L 6.72L-4.48L=2.24L(4分)
(1)4.48L气体中含CO2为6.72L-4.48L=2.24L,O2为2.24L
m(气)=m(CO2)+m(O2)=![]() (2分)
(2分)
(2)n(Na+)=2n(Na2CO3)=2×0.2mol=2×0.2mol=0.4mol
c(Na+)=0.4mol/0.2L=2mol/L (2分)
答:(1)4.48L气体的质量为7.6g (2)最终溶液中Na+的物质的量浓度为2mol/L。