高一化学第一学期期末试卷5
可能用到的相对原子质量:H 1 C 12 O 16 F 19 Na 23 S 32 Cl 35.5 Fe 56
一. 选择题(共20题,每题2分,共40分)在以下各题的四个选项中,只有一个选项是符合题目要求的,将其标号填在下表中。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
1. 下列说法中,不准确的是
A. 燃烧不一定要有氧气参加,但燃烧一定是放热反应
B. 化学反应中的能量变化都表现为热量变化
C. 为保证燃料充分燃烧,通入的空气要适当过量而不是越多越好
D. 为使液体燃料充分燃烧,可以将液体燃料以雾状喷出,这保证了燃料与空气有足够大的接触面积。
2. 下列说法中,错误的是
A. ![]() 是弱电解质,在常温下,其水溶液的
是弱电解质,在常温下,其水溶液的![]() 大于7
大于7
B. 熔融状态下的氢氧化钠能导电
C. 因为![]() 属于微溶物质,所以
属于微溶物质,所以![]() 是弱电解质
是弱电解质
D. 水是弱电解质,液态水中,只有一部分水分子电离成![]() 和
和![]()
3. 下列反应中,既属于氧化还原反应,又是吸热反应的是
A. 铝片与稀盐酸的反应 B.
![]() 与
与![]() 的反应
的反应
C. 灼热的炭与二氧化碳的反应 D. 钾与水的反应
4. 化学反应![]()
![]()
![]() 是一个可逆反应。在持续加热的条件下,向密闭容器中充入2mol
是一个可逆反应。在持续加热的条件下,向密闭容器中充入2mol![]() 和3mol
和3mol![]() 蒸气,充分反应后,HI的物质的量
蒸气,充分反应后,HI的物质的量
A. 等于4mol B. 少于4mol C. 等于6mol D. 多于6mol
5. 下列化学反应的离子方程式,书写正确的是
A. 碳酸钙与稀盐酸反应:![]()
B. 铁跟稀硫酸反应:![]()
C. 钾跟冷水反应:![]()
D. 氢氧化铁溶于盐酸:![]()
6. 下列各组中的离子,能在溶液中大量共存,且溶液呈无色的是
A. ![]() 、
、![]() 、
、![]() 、
、![]() B.
B.
![]() 、
、![]() 、
、![]() 、
、![]()
C. ![]() 、
、![]() 、
、![]() 、
、![]() D.
D.
![]() 、
、![]() 、
、![]() 、
、![]()
7. 将下列物质的量浓度相等的溶液等体积两两混合,有白色沉淀生成,再加入过量的稀硝酸后,沉淀消失并放出气体,又加入![]() 溶液时再次有白色沉淀生成的是
溶液时再次有白色沉淀生成的是
A. ![]() 和
和![]() B.
B.
![]() 和
和![]()
C. ![]() 和
和![]() D.
D.
![]() 和
和![]()
8. 下列说法中,正确的是( )
A. 金属单质在化学反应中总作还原剂
B. 非金属单质在化学反应中一定是氧化剂
C. 元素由化合态转化为游离态,该元素一定被还原
D. 分解反应一定是氧化还原反应
9. 人体血红蛋白中含有![]() 离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使
离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使![]() 转变为
转变为![]() 离子,生成高铁血红蛋白而丧失与
离子,生成高铁血红蛋白而丧失与![]() 结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A. 氧化性 B. 还原性 C. 酸性 D. 碱性
10. 用N表示阿伏加德罗常数的数值,下列说法中,错误的是
A. 活泼金属与盐酸反应,生成了1mol![]() ,发生转移的电子数目为2N
,发生转移的电子数目为2N
B. 23g金属钠所含电子数目为11N
C. 在标准状况下,N个氢分子的体积约为22.4L
D. 醋酸的摩尔质量与N个酸酸分子的质量相等
11. 下列叙述中,错误的是
A. 在标准状况下,气体的摩尔体积约为22.4L/mol
B. 在标准状况下,0.3mol![]() 与0.7mol
与0.7mol![]() 组成的混合气体的体积约为22.4L
组成的混合气体的体积约为22.4L
C. 在非标准状况下,1mol![]() 的体积不可能约为22.4L
的体积不可能约为22.4L
D. 在同温同压下,不同气体分子间的距离几乎相等
12. 20℃时,![]() 的溶解度是36g,此时
的溶解度是36g,此时![]() 饱和溶液的密度为
饱和溶液的密度为![]() ,则此温度下
,则此温度下![]() 饱和溶液中
饱和溶液中![]() 的物质的量浓度为
的物质的量浓度为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
13. 将20mL![]() 溶液跟
溶液跟![]()
![]() 溶液混合,充分反应后过滤,所得滤液中各离子浓度的大小顺序是
溶液混合,充分反应后过滤,所得滤液中各离子浓度的大小顺序是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
14. 下列关于碱金属元素和卤素的说法中,错误的是
A. 随核电荷数的增加,碱金属元素和卤素的原子半径分别逐渐增大
B. 碱金属元素中,锂原子失去最外层电子的能力最弱,锂的金属性最弱
C. 卤素中,氟原子得电子的能力最强,![]() 的氧化性最强
的氧化性最强
D. ![]() 与水的反应比
与水的反应比![]() 与水的反应更剧烈些
与水的反应更剧烈些
15. 关于钠的性质的下列叙述中,说法不正确的是
A. 钠是软金属,其新切表面易失去金属光泽
B. 钠在空气中燃烧,生成氧化钠
C. 钠与硫化合时反应很剧烈,发生爆炸,生成硫化钠
D. 钠很容易与空气中的水蒸气起反应
16. 下列说法中,错误的是
A. 在实验室中,通常将钠保存在煤油里
B. 钠着火时,可用泡沫灭火器(可喷射出大量二氧化碳)灭火
C. 钠和钾的合金(钾的质量分数为50%~80%)在室温下呈液态,是原子反应堆的导热剂
D. 在反应![]() 中,
中,![]() 表现了还原性
表现了还原性
17. 下列说法中,有错误的是
A. ![]() 比
比![]() 容易溶解于水
容易溶解于水
B. 将等物质的量的![]() 粉末与
粉末与![]() 粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈
粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈
C. ![]() 很稳定,而
很稳定,而![]() 受热时容易分解
受热时容易分解
D. ![]() 溶液能与石灰水反应,而
溶液能与石灰水反应,而![]() 溶液不能与石灰水反应
溶液不能与石灰水反应
18. 实验室用![]()
![]() 溶液(浓盐酸)与足量的
溶液(浓盐酸)与足量的![]() 反应,充分反应后,被氧化的
反应,充分反应后,被氧化的![]() 的物质的量
的物质的量
A. 小于![]() B.
等于
B.
等于![]()
C. 在![]() ~
~![]() D.
等于
D.
等于![]()
19. 甲、乙、丙三种溶液中各含有一种![]() (
(![]() 为
为![]() 、
、![]() 或
或![]() )离子。向甲溶液中加淀粉溶液和氯水,则溶液呈现橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙溶液依次含有
)离子。向甲溶液中加淀粉溶液和氯水,则溶液呈现橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙溶液依次含有
A. ![]() 、
、![]() 、
、![]() B.
B.
![]() 、
、![]() 、
、![]()
C. ![]() 、
、![]() 、
、![]() D.
D.
![]() 、
、![]() 、
、![]()
20. 为实现我国消除碘缺乏症的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(![]() )形式存在。已知溶液中
)形式存在。已知溶液中![]() 可以与
可以与![]() 发生如下的反应:
发生如下的反应:![]()
![]()
![]() ,据此反应,可用试剂和一些生活中常见的物质进行实验,证明在食盐中存在着
,据此反应,可用试剂和一些生活中常见的物质进行实验,证明在食盐中存在着![]() 。可供选用的物质是:① 自来水 ② 食醋 ③ 白酒 ④ 食糖 ⑤ 淀粉 ⑥ 碘化钾淀粉试纸 ⑦ 蓝色石蕊试纸。进行上述实验时必须使用的物质是
。可供选用的物质是:① 自来水 ② 食醋 ③ 白酒 ④ 食糖 ⑤ 淀粉 ⑥ 碘化钾淀粉试纸 ⑦ 蓝色石蕊试纸。进行上述实验时必须使用的物质是
A. ①⑥ B. ②⑤⑦ C. ②⑥ D. ①③④⑤⑦
二.(本题共23分)
21.(3分)在反应![]() (浓)
(浓)![]() 中,
是氧化剂, 是氧化产物,3mol
中,
是氧化剂, 是氧化产物,3mol![]() 参加该反应时,反应中转移 mol
参加该反应时,反应中转移 mol![]() 。
。
22.(2分)卤素的单质与氢气反应,所生成的最稳定的氢化物,在标准状况下,224mL的质量= g。
23.(4分)将氢氧化钡溶液与硫酸铜溶液混合,反应的离子方程式为
;与离子方程式![]() 相对应的化学方程式为
。
相对应的化学方程式为
。
24.(2分)根据![]() 所含的碳原子数约为
,可以计算出1个
所含的碳原子数约为
,可以计算出1个![]() 原子的质量约为
kg。
原子的质量约为
kg。
25.(2分)中和16g![]() 固体,刚好消耗一定质量的某二元酸,生成正盐
固体,刚好消耗一定质量的某二元酸,生成正盐![]() 及一定质量的水,则该二元酸的摩尔质量=
,该正盐的摩尔质量=
。
及一定质量的水,则该二元酸的摩尔质量=
,该正盐的摩尔质量=
。
26.(2分)在一定条件下,![]() 与
与![]() 反应,产物是
反应,产物是![]() 和
和![]() ,则与
,则与![]() 反应所需
反应所需![]() 的物质的量为
mol。
的物质的量为
mol。
27.(8分)城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它是由焦炭在高温下与水蒸气反应制得,故又称水煤气。试解答:
(1)写出制取水煤气的主要化学方程式: (要注明反应物和生成物的状态),该反应中的还原剂是 ,已知该反应是吸热反应,则该反应中的反应物的总能量 (选填“大于”或“小于”)生成物的总能量。
(2)设液化石油气的主要成分为丙烷(![]() ),其充分燃烧后产物为CO2和H2O。则使等质量的C3H8及CO分别充分燃烧所消耗的氧气的体积比(同温、同压下)为
),其充分燃烧后产物为CO2和H2O。则使等质量的C3H8及CO分别充分燃烧所消耗的氧气的体积比(同温、同压下)为
。(写出最简整数比)
(3)使用管道煤气必须防止因煤气泄漏而引起的中毒和爆炸。某厨房因煤气泄漏而发生爆炸事故。调查发现煤气是在达到室内原空气质量的6%时发生爆炸的,该住户煤气泄漏速率为3g/min,则爆炸时煤气已泄漏约
h。(假设厨房体积为25m3,空气密度约为![]() )(注min——分钟,h——小时)
)(注min——分钟,h——小时)
三.(本题共25分)
28.(5分)某校实验室的废液中,可能含有碳酸钠、氯化钠、硝酸银、氢氧化钠、盐酸中的一种或几种。向取出的部分原废液中加入铁粉后,产生大量气泡。可以推断出,原废液中肯定不含有上述物质中的 ;不能肯定是否含有上述物质中的
,为确定原废液中是否含有该物质,应继续进行的实验操作是
。
29.(3分)通常用![]() 悬浊液除去混在CO2中的HCl气体,反应的化学方程式为
悬浊液除去混在CO2中的HCl气体,反应的化学方程式为
,不能采用![]() 溶液,其原因是
。
溶液,其原因是
。
30.(4分)实验室要用![]() 溶液(
溶液(![]() 的质量分数为98%)配制
的质量分数为98%)配制![]()
![]() 溶液
溶液![]() 。
。
(1)需准确量取98%的硫酸
![]() 。
。
(2)若配制![]() 溶液的其他操作都正确,但出现下列错误操作,其中将使所配制的溶液中
溶液的其他操作都正确,但出现下列错误操作,其中将使所配制的溶液中![]() 的物质的量浓度偏低的是(填写序号)
。
的物质的量浓度偏低的是(填写序号)
。
A. 将稀释后的硫酸转移至容量瓶中后,未洗涤烧杯和玻璃棒。
B. 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C. 用胶头滴管向容量瓶中加水时,溶液凹液面高于容量瓶刻度线,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度线相切。
D. 用胶头滴管加水时,仰视容量瓶刻度线来定容。
31.(8分)
(1)在实验室里,制取氯气的反应化学方程式为
,若制得的氯气在标准状况下的体积为1.12L,则被氧化的![]() 的物质的量为
mol。
的物质的量为
mol。
(2)实验室中制取氯气应选用的发生装置是 ,收集氯气并吸收多余的氯气应选用的装置是 。(均填写序号)
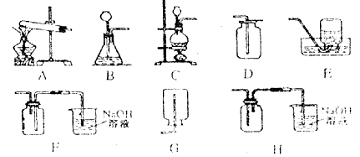
(3)上述装置中,吸收多余的氯气的反应化学方程式为 。
32.(5分)教材上说:过氧化钠能跟二氧化碳起反应——![]()
![]() ,某学生利用实验室里的常用仪器与药品设计了一个实验来验证这一说法。
,某学生利用实验室里的常用仪器与药品设计了一个实验来验证这一说法。
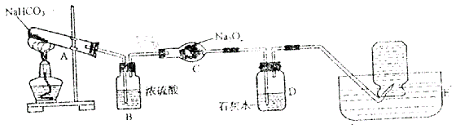
该学生的实验设计思路是严谨的:
(1)装置B中浓硫酸的作用是 ,说明装置C中的![]() 转化为
转化为![]() 并没有经历这样的化学反应:①
(写出化学方程式)、②
并没有经历这样的化学反应:①
(写出化学方程式)、② ![]()
![]()
(2)装置D中的石灰水(足量)没有变浑浊,说明![]() 分解得到的
分解得到的![]() 已经
已经
。
(3)说明反应产物中有![]() 的方法是
。
的方法是
。
四.(本题共12分)
33.(4分)市售浓硫酸中![]() 的物质的量浓度为
的物质的量浓度为![]() ,
,![]() 的质量分数为98%。计算该浓硫酸的密度。
的质量分数为98%。计算该浓硫酸的密度。
34.(8分)把![]() 和
和![]() 的混合物29.6g加热到质量不再变化时,得残留固体26.5g。求原混合物中
的混合物29.6g加热到质量不再变化时,得残留固体26.5g。求原混合物中![]() 与
与![]() 的物质的量之比。
的物质的量之比。
附加题:(共16分)
1.(8分)按下列要求各写一个氧化还原反应的化学方程式,氧元素在反应中:
(1)既有一部分被氧化,又有一部分被还原,如: ;
(2)只被还原,未被氧化,如: ;
(3)只被氧化,未被还原,如: ;
(4)未被氧化,也未被还原,如: 。
2.(8分)有一定质量的铁的氧化物![]() (其中的铁显+2价或+3价,氧显
(其中的铁显+2价或+3价,氧显![]() 价),恰好与
价),恰好与![]() 溶液完全反应。所得溶液吸收了
溶液完全反应。所得溶液吸收了![]() (标准状况)
(标准状况)![]() ,其中的
,其中的![]() 由于发生反应:
由于发生反应:![]() 而恰好完全转化为
而恰好完全转化为![]() 。试求
。试求![]() 与
与![]() 的最简整数比。
的最简整数比。

【试题答案】
一.(40分)每题2分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | C | B | D | D | B | A | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | C | B | D | B | B | D | A | B | C |
二.(23分)
21.(3分)每空1分。![]() ;
;![]() ;5 22.(2分)
;5 22.(2分)![]()
23.(4分)每空2分。![]() ;
;
![]() (答案不唯一)
(答案不唯一)
24.(2分)每空1分。![]() ;
;![]()
25.(2分)每空1分。![]() ;
;![]()
26.(2分)2
27.(8分)
(1)![]() (2分);C(1分);小于(1分)
(2分);C(1分);小于(1分)
(2)![]() (2分) (3)
(2分) (3)![]() (2分)
(2分)
三.(25分)
28.(5分)![]() 、
、![]() 、
、![]() (3分);
(3分);![]() (1分);用铂丝蘸取原废液,放在煤气灯火焰里灼烧,观察火焰的颜色(1分)
(1分);用铂丝蘸取原废液,放在煤气灯火焰里灼烧,观察火焰的颜色(1分)
29.(3分)![]() (2分);
(2分);![]() 溶液会吸收
溶液会吸收![]() (1分)
(1分)
30.(4分)(1)100(2分) (2)A、B、C、D(2分)
31.(8分)
(1)![]() (浓)
(浓)![]() (2分);0.1(2分)
(2分);0.1(2分)
(2)C(1分);H(1分)
(3)![]() (2分)
(2分)
32.(5分)
(1)吸收![]() 分解得到的
分解得到的![]() (1分);
(1分);![]() (2分)
(2分)
(2)与![]() 作用(1分)
作用(1分)
(3)用带有火星的木条检验E装置中的集气瓶里收集到的气体,木条着火(1分)
四.(12分)
33.(4分)
解:![]()
![]()
答:该浓硫酸的密度为![]() 。
。
34.(8分)
解: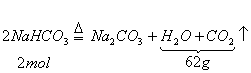
![]()
![]()
混合物中![]() 与
与![]() 的物质的量之比为
的物质的量之比为
![]()
![]()
答:混合物中![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]() 。
。
附加题:(16分)
1.(8分)每个化学方程式2分。答案均不唯一,只要符合要求均可。
(1)![]()
(2)![]()
(3)![]()
(4)![]()
2.(8分)
解:![]() 与
与![]() 反应后生成的
反应后生成的![]() 和
和![]() 中共含有
中共含有![]() 的物质的量为
的物质的量为
![]()
![]()
![]()
![]()
![]()
![]()
则![]() 与
与![]() 反应后,生成
反应后,生成![]()
原![]() 中含显+2价的
中含显+2价的![]() 原子
原子![]() ,含
,含![]()
![]() 中含
中含![]()
![]()
则![]() 与
与![]() 反应后,生成的
反应后,生成的![]() 中含
中含![]() ,即生成
,即生成![]()
原![]() 中含显+3价的
中含显+3价的![]() 原子
原子![]() ,含
,含![]()
所以![]() 与
与![]() 的最简整数比
的最简整数比![]()
答:![]() 与
与![]() 的最简整数比为
的最简整数比为![]() 。
。
【试卷分析】
本套试卷难易适中,但题量较大,在90分钟之内准确,快速地完成全部试题,考查了同学对知识熟练掌握并灵活运用的能力,也是对同学心里素质的一次锻炼。
难度比例为:易![]() 中
中![]() 难=
难=![]() (包括16分的附加题),知识覆盖面广,几乎涵盖了1—4章的所有知识点,问题角度新颖,有很好的区分度。
(包括16分的附加题),知识覆盖面广,几乎涵盖了1—4章的所有知识点,问题角度新颖,有很好的区分度。
| 年级 | 高一 | 学科 | 化学 | 版本 | 人教大开本、3+x | 期数 | |||||||
| 内容标题 | 第一学期高一化学期末试卷 | ||||||||||||
| 分类索引号 | G.624.6 | 分类索引描述 | 考试试题与题解 | ||||||||||
| 主题词 | 天津河西区2003—2004学年度第一学期高一化学期末试卷 | 栏目名称 | 名校题库 | ||||||||||
| 供稿老师 | 张欣 | 审稿老师 | |||||||||||
| 录入 | 一校 | 二校 | 审核 | ||||||||||