高一化学第一学期期终调研考试试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间100分钟。
第Ⅰ卷(选择题 共48分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:
H-1 C-12 O-16 F-19 Na-23 Cl-35.5 Ag-108
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意。)
1.下列燃料中,不属于化石燃料的是
A.煤 B.天然气 C.石油 D.氢气
2.2003年10月15日,我国成功地用“长征”二号F运载火箭发射了“神舟”五号载人航天飞船,并于次日成功回收。该运载火箭使用偏二甲肼[NH2N(CH3)2]和四氧化二氮(N2O4)作为推进剂,发生反应后生成N2、CO2和H2O(g)。则该反应中N2O4
A.只是氧化剂 B.只是还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
3.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后,Na2SO3转化为
A.Na2SO4 B.SO2 C.S D.Na2S
4.下列关于卤素化合物用途的叙述中错误的是
A.含氟牙膏能有效预防蛀牙
B.医疗上用饱和食盐水做生理盐水
C.溴化银可用于制胶卷和相纸
D.碘化银可用于人工降雨
5.欲除去氯化氢气体中混有的少量氯气,可将混合气体通过
A.饱和食盐水 B.氢氧化钠 C.灼热的铜网 D.浓硫酸
6.反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,若有0.3 mol HCl被氧化,则下列说法正确的是
A.有0.3 mol Cl2生成 B.得到0.3 mol氧化产物
C.有0.3 mol HCl参加反应 D.有0.3 mol电子发生转移
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
7.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.质量 B.密度 C.物质的量 D.分子数
8.“非典”期间,某同学将食盐溶解于水,通直流电电解(2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑),并将生成的Cl2与NaOH溶液反应得消毒液。该消毒液的有效成分是
2NaOH+H2↑+Cl2↑),并将生成的Cl2与NaOH溶液反应得消毒液。该消毒液的有效成分是
A.NaClO B.NaOH C.NaCl D.Cl2
9.下列各组离子中,在酸性溶液中能够大量共存,且通入Cl2后没有明显变化的是
A.K+、Na+、Cl-、I- B.Ca2+、Mg2+、HCO3-、NO3-
C.K+、Cu2+、SO42-、Cl- D.Ag+、Ba2+、NO3-、CO32-
10.下列离子方程式的书写正确的是
A.金属钠与水反应:Na+H2O=Na++OH-+H2↑
B.小苏打和烧碱在溶液中反应:OH-+HCO3-=H2O+CO2↑
C.碘化钾溶液中加入少量溴水:2I-+Br2=I2+2Br-
D.用大理石与盐酸制取二氧化碳:CaCO3+2H+=Ca2++H2O+CO2↑
11.按照Li、Na、K、Rb、Cs的顺序,下列叙述中错误的是
A.原子半径依次增大
B.单质还原性依次增强
C.单质熔点依次降低
D.单质密度依次减小
12.用NA表示阿伏加德罗常数,下列叙述中,正确的是
A.常温常压下,11.2 L氯气所含的原子数为NA
B.常温常压下,钠与水反应生成1 g氢气转移电子数为NA
C.1 L 1 mol·L-1的CH3COOH溶液中含H+离子数为NA
D.1.9 g的H3O+离子中含有的电子数为1.1 NA
13.在两支试管中分别加入等物质的量的Na2CO3粉末和NaHCO3粉末,同时向两支试管中加入等体积、等物质的量浓度的稀盐酸(足量)。下列说法中正确的是
A.加NaHCO3粉末的试管中产生二氧化碳气体的速率快
 B.两支试管中产生二氧化碳气体的速率一样快
B.两支试管中产生二氧化碳气体的速率一样快
C.两支试管中产生二氧化碳气体的体积一样大
D.加NaHCO3粉末的试管中产生二氧化碳气体的体积大
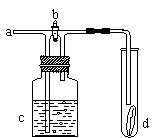
14.如右图所示,从a处通入氯气。若打开活塞b,d处的有色布条不褪色;若关闭活塞b,d处的有色布条褪色。下列判断正确的是
A.a处通入的是潮湿的氯气
B.a处通入的是干燥的氯气
C.c中盛放的可能是浓硫酸
D.c中盛放的可能是蒸馏水
15.为消除碘缺乏病,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在酸性溶液中IO3-离子可和I-离子发生反应:IO3-+5I-+6H+=3I2+3H2O。根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。
进行上述实验时必须使用的物质是
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
16.在50 g含有1.17 g氯化钠和0.84 g氟化钠的溶液中滴入过量的硝酸银溶液,充分搅拌、静置、过滤、洗涤、干燥,称量得到2.87 g固体。由此可得出的正确结论是
A.氯离子全部参加了反应
B.氟离子全部参加了反应
C.氟化银难溶于水
D.氟化银易溶于水
第Ⅱ卷(非选择题 共52分)
三、(本题包括2小题,共14分)
17.(4分)要配制浓度为2.0 mol·L-1 的NaOH溶液100 mL,下面的操作不正确的是____________(填代号)。
A.称取8.0 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8.0 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8.0 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.称取8.0 g NaOH固体,放入100 mL烧杯中,加少量蒸馏水同时不断搅拌,待固体完全溶解后,趁热将烧杯中的溶液倒入100 mL容量瓶中,然后加入蒸馏水到刻度,盖好瓶塞,反复摇匀
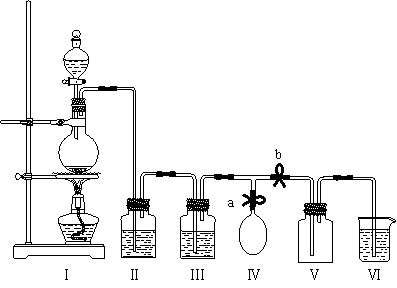 |
18.(10分)某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
⑴写出该反应的化学方程式并标出电子转移的方向和数目。
⑵装置Ⅲ中盛放的药品是_____________,其作用是________________________。
⑶装置Ⅵ中盛放的药品是_____________,其作用是________________________。
⑷实验开始后,___________________________________________(用“打开”或“关闭”等简洁的语言叙述对弹簧夹a和b的操作,下同);当集满一瓶氯气时,_________
____________________________,使氯气储存在气球中;换好集气瓶后,_____________
__________________________,继续收集氯气。
四、(本题包括2小题,共13分)
19.(4分)人们常利用化学反应中的能量变化为人类服务。
⑴将30 g碳酸钠晶体与20 g硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温。当外出旅游时,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量__________(填“高于”或“低于”)反应后生成产物的总能量。
⑵煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与下列示意图中的_________(填字母代号)最相符。
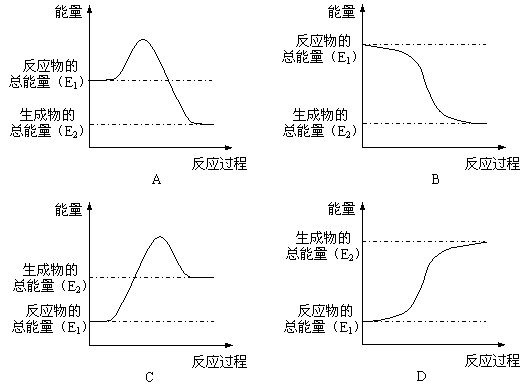 |
⑵化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其它形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这是将化学能转化为___________;人们普遍使用的干电池,是将化学能转化为___________。
20.(9分)为探究氯水中除H2O分子外还含有哪些粒子,某化学兴趣小组做了如下实验:
⑴观察氯水颜色,发现氯水呈黄绿色,说明氯水中肯定含有的粒子是(填化学式,下同)______________;
⑵取少量氯水于试管中,滴入硝酸酸化的AgNO3溶液,有白色沉淀生成,说明氯水中含有的粒子是___________;
⑶另取少量氯水于表面皿中,将一块蓝色石蕊试纸置于其中,发现试纸先变红然后褪色,说明氯水中含有的粒子是_________和_________;
⑷以上实验不能说明溶液中是否有_________________存在;
⑸通过以上实验说明氯气与过量的水的反应是___________(填“完全”、“不完全”)的,因此氯气与水的反应是一个____________(填“可逆”、“不可逆”)反应,该反应的离子方程式是_________________________________________。
五、(本题包括2小题,共12分)
21.(4分)某固体混合物可能由KNO3、K2SO4、CaCl2、NaCl、CuCl2、Na2CO3中的一种或几种组成,依次进行如下实验,观察到的实验现象记录如下:
①用干净的铂丝蘸取混合物在酒精灯火焰上灼烧,透过蓝色的钴玻璃,可以观察到火焰呈紫色;
②混合物加水得到无色溶液;
③向上述溶液中滴加过量BaCl2溶液,有白色沉淀生成,将该沉淀滤出,此沉淀可完全溶于稀硝酸;
④向③的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
据此,可判断混合物中肯定含有 ,不能肯定是否含有 (均用化学式填写)。
22.(8分)根据下列反应框图填空。已知B、D、E、L常温下均为密度比空气大的气体,D呈黄绿色,其他无色,D、E为单质,其他为化合物。A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,G难溶于水,L能使湿润的蓝色石蕊试纸变红。
 |
⑴F的俗名是__________________;
⑵反应①的用途是____________________________________________;
⑶反应②在实验室常被用来____________________________________;
⑷工业上利用反应③生产______________________________________;
⑸另有两种物质能与H反应生成E,写出这两个反应的化学方程式:
_______________________________________________
_______________________________________________
六、(本题包括2小题,共13分)
23.(6分)将标准状况下13.44 L氯化氢气体溶解于水后配成50.0 mL溶液,得到密度为1.19 g·cm-3的盐酸。试计算:
⑴所得盐酸的物质的量浓度。
⑵该盐酸中溶质的质量分数。
24.(7分)在1.00 L 1.00 mol·L-1 NaOH溶液中通入16.8 L标准状况下的CO2。
⑴计算所得溶液中含有的NaHCO3和Na2CO3的物质的量。
⑵将上述溶液蒸干、灼烧,可以得到Na2CO3多少克?
高一化学第一学期期终调研考试
参考答案及评分标准
一、选择题(本题包括6小题,每小题3分,共18分。)
1.D 2.A 3.A 4.B 5.C 6.D
二、选择题(本题包括10小题,每小题3分,共30分。)
7.CD 8.A 9.C 10.CD 11.D 12.B 13.AC 14.BD 15.B 16.AD
三、(本题包括2小题,共14分)
17.A、B、C、D
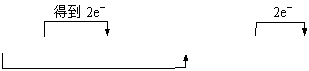 18.⑴
18.⑴
4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑或4HCl(浓)+MnO2
MnCl2+2H2O+Cl2↑或4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
|
⑵浓硫酸 除去HCl气体中可能混有的水蒸气 ⑶NaOH溶液 吸收多余的Cl2
⑷打开b、关闭a 打开a、关闭b 打开b、关闭a
(化学方程式2分,电子转移方向及数目1分,其他每空1分,共10分。)
四、(本题包括2小题,共13分)
19.⑴低于 ⑵A ⑶光能 电能 (每空1分,共4分。)
20.⑴Cl2 ⑵Cl- ⑶H+ HClO ⑷ClO-、OH-、HCl(填写任意一种即可) ⑸不完全 可逆 Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
(离子方程式2分,其他每空1分,共9分。离子方程式不写可逆符号不给分。)
五、(本题包括2小题,共12分)
21.Na2CO3、KNO3 NaCl (每空2分,共4分。)
22.⑴纯碱(或苏打) ⑵呼吸面具(或潜水艇、航天飞船等)中作为氧气的来源 ⑶鉴定CO2 ⑷漂白粉(或漂粉精) ⑸2Na2O2+2H2O=4NaOH+O2↑ 2F2+2H2O=4HF+O2↑
(化学方程式每个2分,其他每空1分,共8分。)
六、(本题包括2小题,共13分)
23.⑴c(HCl)=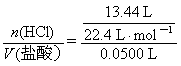 =12.0 mol·L-1
=12.0 mol·L-1
⑵w(HCl)=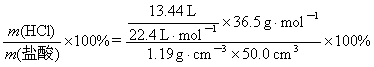 =36.8%
=36.8%
(每小题3分,共6分。分步列式或其他合理解法同样给分。)
24.⑴n(CO2)=![]() =0.750 mol
=0.750 mol
n(NaOH)=1.00 L×1.00 mol/L=1.00 mol
根据元素守恒:
![]() n(NaHCO3)+n(Na2CO3)=0.750 mol
(1分)
n(NaHCO3)+n(Na2CO3)=0.750 mol
(1分)
n(NaHCO3)+2n(Na2CO3)=1.00 mol (1分)
解得:n(NaHCO3)=0.500 mol
n(Na2CO3)=0.250 mol (2分)
⑵n(Na2CO3)=![]() n(NaOH)=0.500 mol
(2分)
n(NaOH)=0.500 mol
(2分)
m(Na2CO3)=0.500 mol×106 g/mol=53.0 g (1分)
(其他合理解法参考此标准给分。)