高一化学碱金属
一、选择题(本题共20小题,每小题3分,共60分。每小题只有一个选项符合题意。)
1. 常温常压下,下列物质在空气里不发生变化的是 ( )
A. Na2CO3·10H2O B. NaHCO3 C. Na D. NaOH
2.下列化合物能通过相应单质直接化合而成的是 ( )
A. FeCl2 B. CuS C. Na2O2 D. SO3
3. 实验室要使用坩埚熔化苛性钠,应选用 ( )
A. 铁坩埚 B. 玻璃坩埚 C. 石英坩埚 D. 瓷坩埚
4.关于ⅠA族和ⅡA族元素的下列说法中正确的是 ( )
A. 在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B. 浓度都是0.01 mol·L-1时,氢氧化钾溶液的pH比氢氧化钡的小
C. 氧化钠的熔点比氧化镁的高
D. 加热时,碳酸钠比碳酸镁易分解(MCE99)
5. 下列物质中,能使品红溶液褪色的是 ( )
①干燥的氯气 ②Na2O2 ③NaClO ④亚硫酸酐
A. 除①外其余都可以 B. 只有①③④ C. 只有①④ D. 全部都可以
6. 下列混合物溶于水,所得溶液中溶质只有一种的是 ( )
A. Na2O2和Na2CO3 B. Na和NaCl
C. Na2O和Na2O2 D. NaOH和Na2CO3
7. 用Na2O2与水反应制O2,应选作该反应容器的材料是 ( )
A. 玻璃 B. 铁 C. 铝 D. 塑料
8. 在下列反应中,水作还原剂的是 ( )
A. Na+H2O → B. Na2O2+H2O →
C. F2+H2O → D. CaO+H2O →
9. 下列物质在强光照射下,不发生化学反应的是 ( )
A. 氢、氯混合气 B. 浓硝酸 C. 过氧化钠 D. 新制的氯水
10. 下列各种固体物质的热稳定性强弱顺序排列错误的是 ( )
A. KMnO4>K2MnO4 B. KCl>KClO3
C. Na2O2>Na2O D. Na2CO3>NaHCO3
11. 电子工业制造光电管时,需要一种经强光照射就失去电子,从而接通电路的材料,制造这种材料的物质是 ( )
A. 放射性元素 B. ⅦA族元素 C. 卤化银 D. ⅠA族的单质
12. 锂是一种活泼金属,它在工业上的用途为 ①光电材料 ②化学工业上的催化剂 ③原子反应堆的导热剂 ④制取高强度玻璃 ⑤制热核反应的材料 ( )
A. ①④ B. ②③⑤ C. ②④⑤ D. ①③⑤
13. 过氧化钠与足量NaHCO3的混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是 ( )
A. Na2CO3和Na2O2 C. Na2CO3 B. Na2CO3和NaOH D. Na2O、Na2O2和Na2CO3
14. CO2跟下列物质反应能产生O2的是 ( )
A. NaOH B. Na2O C. Na2O2 D. Na2CO3
15. 超氧化钾(K2O)常用于急救器中,它能吸收CO2变成碳酸盐和O2。在一定条件下,156 g金属钾与O2充分反应生成KO2,若用生成的KO2完全吸收CO2,则生成的O2在标准状况下的体积是 ( )
A. 11.2 L B. 22.4 L C. 44.8 L D. 67.2 L
16. 将MgCl2和NaHCO3按物质的量1∶2的比例混合制成溶液, 再加热蒸干得到的固体是 ( )
A. Mg(HCO3)2和NaCl B. Mg(OH)2和NaCl
C. MgCl2和Na2CO3 D. MgCO3和NaCl
17.能正确表示下列反应的离子方程式是 ( )
A. 硫化亚铁跟稀盐酸反应:FeS+2H+ = Fe2++H2S↑
B. 氯气跟水反应:Cl2+H2O = 2H++Cl-+ClO-
C. 钠跟水反应:Na+2H2O = Na++2OH-+H+↑
D. 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++![]() = BaSO4↓
= BaSO4↓
根据以下叙述,回答第18 ─ 20题:
某化工厂按如下步骤进行生产:①以煤为燃料煅烧石灰石;②用饱和碳酸钠溶液充分吸收步骤①中产生的二氧化碳;③使步骤①中产生的氧化钙跟水反应;④消石灰跟碳酸钠反应。
18. 该厂生产过程中涉及的物质有:①石灰石,②纯碱,③小苏打,④烧碱,⑤二氧化碳,⑥消石灰。下列叙述正确的是 ( )
A. 起始原料是①④ B. 起始原料是②⑥
C. 最终产品是④⑤ D. 最终产品是③④
19. 该厂生产过程的优点可能有:①排放的气体对大气无污染;②生产过程中的部分产品可作为起始原料使用;③无高温作业,其中正确的是 ( )
A. 只有① B. 只有② C. ①和③ D. ②和③
20. 生产过程中没有涉及的化学反应类型是 ( )
A. 分解反应 B. 化合反应 C. 置换反应 D. 复分解反应
二、填空题(本题包括7小题,共30分)
21. (2分)单质钠在空气中燃烧时火焰的颜色为_______色,产物为_______ 色固体,其电子式为_____________,它可以作为潜水艇里______________的来源。
22. (4分)写出能跟强酸作用,又能跟强碱作用的四种酸根不同的钠盐的化学式:
______________ 、_____________ 、______________ 、______________ 。
23. (3分)现有36 g H2O和80 g D2O。它们所含氧原子数之比是_________,它们分别跟金属钠完全反应时,所放出的气体体积比是___________,质量比是__________。
24.(4分)已知:(MCE02)
① A、B、C、D四种物质均含有元素X,有的还可能含有元素Y、Z。元素X、Y、Z的原子序数依次递增。
② X在A、B、C、D中都不呈现它的最高化合价。
③ 室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④ 化合物D受热催化分解,可制得元素Y的单质。
(1) 元素X是 ,Z是 。
(2) 写出③中反应的化学方程式
(3) 写出④中反应的化学方程式
25. (6分)苏打和小苏打有着广泛应用。 试从反应物的消耗量角度来说明在下列用途中选用苏打还是小苏打,为什么?
(1) 做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用___________,因为____________________________________________________________;
(2) 作为泡沫灭火器中的药品,选用______________,因为__________________________
________________________________________________________________;
(3) 用于洗涤餐具及实验室的玻璃仪器等,选用____________,因为__________________
________________________________________________________________。
26. (8分)在三个密闭容器内分别装有:A. Na2O2和NaHCO3、B. Na2O2和NH4HCO3、 C. Na2O2和Ca(HCO3)2,其中每种物质均为1 mol。将它们加热至300℃,经充分反应后排出气体。写出各容器内残留的固体物质名称及物质的量。A______________________________,B____________________________,C__________________________________。
若分别加入相同浓度的足量稀硫酸与残留物完全反应,则消耗硫酸的体积从大到小的顺序依次为______________________________。(填入序号)
27. (3分)向一盛有足量Na2O2的密闭容器中充入一定量CO与CO2的混合气, 不断用电火花引发,最后剩余气体是_____________,所充入的混合气中CO2与CO的物质的量之比为________。若测得反应后容器内压强为反应开始时的![]() (相同条件下),则原混合气的平均相对分子质量为_________。
(相同条件下),则原混合气的平均相对分子质量为_________。
三、计算题(10分)
28. 将Na2O2、NaHCO3组成的混合物分成等质量的两份,向第一份中加入100 mL盐酸,充分反应后恰好成中性,放出的气体在标准状况下共2.24 L。将此气体通入第二份混合物中,充分反应后,气体体积变为2.016 L。求加入的盐酸的物质的量浓度。
答 案
1.B 2.C 3.A 4.B 5.D 6.C 7.D 8.C 9.C 10.A 11.D 12.C 13.C 14.C 15.D 16.B 17 A. 18.D 19.B 20.C
21. (每空0.5分)黄; 淡黄; ![]() ; 氧气
; 氧气
22. (每空1分)NaHCO3; NaHS; NaH2PO4; NaHSO3; (CH3COONa; Na2HPO4)
23. (每空1分)1∶2; 1∶2; 1∶4
24. (1) Cl(或氯);K(或钾)
(2) Cl2+2KOH=KCl+KClO+H2O
(3) ![]() (每空1分)
(每空1分)
25. (每空1分)(1)苏打; 中和等量的H+,Na2CO3比NaHCO3的用量少 (2)小苏打; 产生等量的CO2,NaHCO3比Na2CO3的用量少 (3)苏打; Na2CO3的水解程度大, 产生等量的OH-,需Na2CO3的量比NaHCO3少
26.(每空2分)1 mol Na2CO3和1 mol NaOH; 1 molNa2CO3; 1 molNa2CO3和1 molCaCO3; C>A>B
27. (每空2分)O2; 任意比; 32
28. NaHCO3与盐酸反应产生CO2,Na2O2与盐酸反应生成O2,而CO2与Na2O2反应将产生O2,故两步反应后的剩余气体一定有O2,可能有CO2。
2.24 L为0.1 mol,2.016 L为0.09 mol。 (1分)
2Na2O2+2CO2=2Na2CO3+O2 D n
0.02 0.02 0.01 0.1-0.09=0.01 (2分)
⑴ 若CO2完全反应,
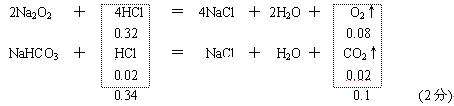
c(HCl) =
![]() = 3.4 mol / L
(1分)
= 3.4 mol / L
(1分)
⑵ 若CO2未完全反应,则Na2O2应是0.02 mol, (1分)
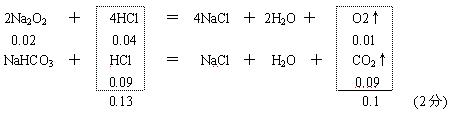
c(HCl) =
![]() = 1.3 mol / L
(1分)
= 1.3 mol / L
(1分)