高一化学期末考试试卷
| 题 号 | 一 | 二 | 三 | 四 | 总 分 |
| 得 分 |
一、选择题:(本题共8小题,每题2分,共16分,每题只有一个正确答案)
1.为防止贮存液氯的钢筒被腐蚀,钢筒装置氯时必须 ( )
A.充入稀有气体 B.除去铁锈 C.彻底干燥 D.放入铁粉
2.1 L某溶液含有(NH4)2SO4和MgSO4共19.2g,溶液中硫酸根离子浓度为0.15mol/L,溶液
中NH的物质的量是 ( )
A.0.01mol B.0.05mol C.0.1mol D.0.2mol
3.在同温同压下,10mL气体A2和30mL气体B2完全反应可生成20mL气体C,则C的化
学式应为 ( )
A.A2B6 B.A2B3 C.A3B D.AB3
4.钾、钠合金(含50%—80%钾)可作原子反应堆的导热剂,下面有关该合金的事实与此应
用无关的是 ( )
A.熔点260.7K B.具有很高的比热 C.可作冷却剂 D.能跟水剧烈反应
5.下列变化规律的叙述中,正确的是 ( )
A.F-、Cl-、Br-、I-的还原性逐渐减弱
B.NaOH、KOH、RbOH的碱性逐渐减弱
C.Li、NA.K、RB.Cs金属性逐渐减弱
D.HF、HCl、HBr、HI的稳定性逐渐减弱
6.下列各组离子在溶液中能够大量共存的是 ( )
A.Mg2+、Cl-、H+、SO B.H+、HCO、Na+、Cl-
C.Na+、OH-、Ba2+、CO D.K+、Cl-、NO、Ag+
7.下列物质的水溶液中,加入Ba(OH)2溶液后原溶液中阴阳离子都减少的是 ( )
A.CuSO4 B.Ca(NO3)2 C.Na2CO3 D.FeCl3
8.下列叙述中,正确的是 ( )
A.氯水是盐酸和次氯酸的混合物
B.把Na2O2隔绝空气加热即转变为Na2O
C.在NaHCO3水溶液中加入澄清石灰水,有白色沉淀生成
D.任何酸式盐的溶解度都较其正盐的溶解度大(同温)
二、选择题(本题共10小题,每题2分,共20分;每小题有1—2个正确答案)
9.下列各物质中,后一种物质的热稳定性比前一种强的是 ( )
A.Na2CO3和NaHCO3 B.Na2O2和Na2O
C.K2MnO4和KMnO4 D.HBr和HCl
10.0℃、1.01×105Pa下,下列混合气体的平均式量有可能为40的是 ( )
A.H2和O2 B.H2和SO2 C.SO2和HBr D.HI和Cl2
11.若NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.在标准状况下,NA个水分子所占的体积约为22.4L
B.5.6g铁与氯气完全反应,失去电子的数目为0.3NA
C.1 mol Cl2发生化学反应,转移的电子数必为2NA
D.CH4的摩尔质量与NA个CH4分子的质量在数值上相等
12.已知阿伏加德罗常数、物质的摩尔质量及摩尔体积,下列物理量中尚不能全部计算出其
近似值的是 ( )
A.固体物质分子的大小和质量 B.液态物质分子的大小及质量
C.气体物质分子的大小和质量 D.气体物质分子的质量
13.2.8克碱石灰(CaO)和NaOH的混合物)投入50毫升2摩/升的盐酸中所得溶液的pH
值 ( )
A.大于7 B.小于7 C.等于7 D.无法确定
14.当试管中沾有污物时,下列洗涤方法中,错误的是 ( )
A.用酒精洗去碘 B.用稀H2SO4洗去CaCO3
C.用热的浓盐酸洗去MnO2 D.用盐酸洗去Ca(OH)2
15.绝大多数盐类是强电解质,而醋酸铅是弱电解质。能证明醋酸是弱电解质的方法是
( )
①比较相同浓度的醋酸铅和硫酸镁溶液的导电性 ②硫酸铅沉淀中加入醋酸铵,沉
淀消失 ③测定醋酸铅的熔点 ④测定醋酸铅的溶解度
A.①② B.①③ C.②④ D.③④
16.甲、乙两烧杯中分别加入等体积、等浓度的稀H2SO4,向甲烧杯中加入m gMg,向乙烧
杯中加入m gZn。待反应完毕后,一烧杯中仍有金属未溶解,则甲、乙烧杯中原来的H2SO4
物质的量x值的取值范围是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
17.24 mL浓度为0.05 mol·L-1的Na2SO3溶液,恰好与 20 mL浓度为0.02 mol·L-1的
K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是 ( )
A.+6 B.+3 C.+2 D.0
18.某密闭容器的质量为50.0g,当它装满CO2气体质量为58.8g,如果在同样条件下改为装
满CH4气体,其质量应为 ( )
A.3.2g B.58.8g C.22.4g D.53.2g
三、填空题:(44分)
19.(4分)选择下列物质:氯气、铜、碘化氢、溴化钾溶液,写出符合条件的化学方程式:
(1)一种单质氧化另一种单质:____________________________________________。
(2)一种单质氧化一种化合物中的阴离子:__________________________________。
(3)同一种物质中两种元素间发生氧化还原反应:____________________________。
(4)氯气在反应中既作氧化剂又作还原剂:__________________________________。
20.(4分)法医做指纹显影实验时,先对准指纹处喷洒AgNO3溶液,使之与人体分泌出汗
水中的某一种离子结合,然后进行光照处理,就可显出指纹。请回答:
(1)该指纹显影实验的原因是:_______________________________________________
____________________________________________________________________ .
(2)整个实验过程中所发生反应的化学方程式是_______________________________
21.(6分)向20mL0.2mol/LNaOH溶液中缓缓通入一定量的CO2气体,将溶液在一定条件
下蒸干,若得到白色固体是纯净物,则通入CO2的体积应为_________mL(标准状况),
写出有关离子方程式:_________________________________________________ __。
将上述白色 固体加水溶解,加盐酸至pH=7,再蒸干,得白色固体质量为__________g。
22.(7分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表
| |
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)。
(2)浓盐酸在反应中显示出来的性质是______________(填写编号,多选倒扣分)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子的物质的量为_________mol。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位体积得到的
电子数表示)是Cl2的_______ 倍。
23.(6分)在含有35.8克Na2CO3和NaHCO3溶液内,加入1摩/升的盐酸700毫升,反应完
全后可以生成8.96升CO2(标准状况)。问:(1)其中__________物质过剩;(2)溶液
中Na2CO3有__________g;(3)若上述溶液内加入1摩尔的盐酸450毫升,反应完全后,
在标准状况下可生成CO2__________升。
24.(3分)称取一定质量的纯碱,溶于水后跟盐酸完全反应放出CO2。用“增多”或“减少”
回答以下问题:
(1)若纯碱中含有NaHCO3,则所需盐酸用量____ _______。
(2)若纯碱中含K2CO3,则所需盐酸用量________ _______。
(3)若纯碱中含NaCl,则所需盐酸用量____ ____________。
25.(4分)从海水中制取溴的过程是把Cl2通入加热到90℃, pH=3.5的卤水中,将Br-氧
化为Br2,用空气吹出生成的Br2,被Na2CO3溶液吸收得到NaBr和NaBrO3混合液 ,
再用酸酸化混合液,即可得到Br2。写出有关的离子方程式。
(1)Na2CO3溶液吸收Br2:_____________________________________________。
(2)用酸酸化混合液制取Br2:_________________________________________。
26.(4分)将50g16%的Na2CO3溶液和65.6g8%的Na2CO3溶液混合,得到密度为1g/cm3的
溶液。该溶液溶质的质量分数为____________;该溶液物质的量浓度为__________。
27.(6分)按下图装置好实验仪器和药品,通入Cl2,先排出装置中的空气,直至玻璃中充
满足够气体时,管内气体呈__________色,加热金属钠,使其熔化并开始剧烈反应,看
到的现象是钠燃烧的火焰呈__________(填颜色),并有________产生,反应完全后,
停止加热,冷却后,看到试管壁上有_________色固体附着,尾气吸收的离子方程式是
__________________________________________________,实验室制Cl2的化学方程式
是_______________________________________________________________________。
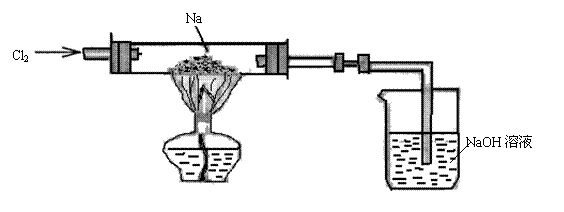 |
四、简答题:(2分)
 28.有两种白色固体为AgCl和BaSO4,设计一个实验把它们区别开来。
28.有两种白色固体为AgCl和BaSO4,设计一个实验把它们区别开来。
五、实验题:(8分)
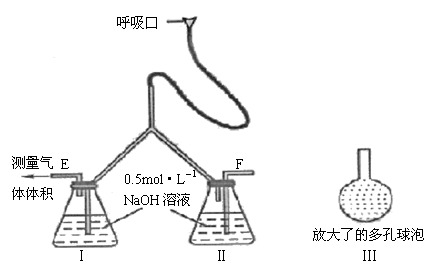
29.为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实
验装置,实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后
的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空:
(1)图中瓶II的作用是_____________________________________________________。
(2)对实验装置尚有如下A.B.C.D四种建议,你认为合理的是(填代号)______
A.在E处增加CaCl2干燥管 B.在F处增加CaCl2干燥管
C.在E和F两处增加CaCl2干燥管 D.不必增加干燥管
(3)将插入溶液的管子下端改成具有多孔的球泡(图中的III),有利于提高实验的准确
度,其理由是__________________________________________________
_______________________________________________________________________
_____________________________________________________________________。
(4)实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重a g,收
集到的气体体积为b L(标准状况)。在呼出气体中CO2的体积分数是(列出算式):
______________________________________________________________________。
(5)实验中若猛吸猛呼,会造成不安全后果,猛吸时会_____________________________
________________________________________;猛呼时会_____________________
_____________________________________________________________________。
六、计算题:
30.(4分)16.6g卤化钾与足量的硝酸银溶液反应,生成23.5g沉淀,求该卤化钾中卤原子
的相对原子质量。
31.(6分)向300mLKOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下
蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,
并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。请通过计算确定
此白色固体是由哪些物质组成的?
高中学生学科素质训练
高一化学期末考试参考答案
一、选择题:
1、C 2、D 3、D 4、D 5、D 6、A 7、A 8、C
二、选择题:
9、D 10、BD 11、BD 12、C 13、A 14、B 15、A 16、C 17、B 18、D
|
|
19、(1)Cl2+Cu CuCl2 (2)Cl2+H2S==S+2HCl (3)H2S H2+S (4)Cl2+H2O==HCl+HClO
|
(2)Cl-+Ag+==AgCl↓
2AgCl Ag+Cl2↑
21、44.8mL或89.6mL 2OH-+CO2==CO32-+H2O OH-+CO2==HCO3-
22、(1)2 4,2,2 1 2 H2O (2)②
23、(1)盐酸 (2)10.6 (3)7.84 HCl量少,有一部分Na2CO3只能生成NaHCO3
24、(1)减少 (2)减少 (3)减少
25、(1)3CO32-+3Br2==5Br-+BrO3-+3CO2↑ (2)5Br-+BrO3-+6H+==3Br2+3H2O
26、11.5% 1.08mol/L
|
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
28、分别取少量白色固体,光照,颜色变黑的是AgCl
29、(1)除去空气中的CO2 (2)D (3)增大接触面积,使CO2充分吸收
(4)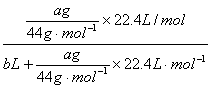 (5)I瓶中NaOH吸入口中 II瓶中NaOH吹出瓶外
(5)I瓶中NaOH吸入口中 II瓶中NaOH吹出瓶外
30、解: KX ~ AgX
(39+x) △m=108-39=69
16.6 △m'=23.5g -16.6g=6.9 g ∴x=127
31、(1)可能组成 KOH K2CO3; K2CO3;K2CO3 KHCO3;KHCO3
(2)若全是K2CO3 质量为13.8g
若全是KHCO3 质量为10g
因为:10<11.9<13.8 ∴ 白色固体由K2CO3、KHCO3混合物组成。