高一化学期中考试试卷
| 题 号 | 一 | 二 | 三 | 四 | 总 分 |
| 得 分 |
一、选择题(每小题2分,共10小题,计20分,每小题只有一个正确答案)
1.1965年,我国科学家在世界上首次用化学方法合成的具有生物活性的物质是 ( )
A.血红素 B.叶绿素 C.核糖核酸 D.结晶牛胰岛素
2.某物质的焰色反应为浅紫色,则该物质一定是 ( )
A.钾的单质 B.钾的化合物 C.含有钾元素 D.含有钾离子
3.下列反应中,不属于氧化还原反应的是 ( )
A.2H2O2==2H2O+O2↑ B.2FeCl2+Cl2==2FeCl3
C.Pb2++2Cl-==PbCl2↓ D.Sn2++2Fe3+==Sn4++2Fe2+
4.在正常条件下,下列燃料中,产生的污染物浓度最低的是 ( )
A.天然气 B.石油 C.煤 D.木材
5.下列各组离子能在酸性溶液中大量共存的是 ( )
A.Ba2+, Ag+, Cl- B.Ca2+, NO, Mg2+
C.Na+, CO, Fe2+ D.Cu2+, SO42-,OH-
6.为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的是 ( )
A.加热,观察是否有气体放出 B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀 D.加热后称量,看质量是否变化
7.下列叙述中,正确的是 ( )
A.液态氯化氢不导电,故氯化氢是非电解质
B.二氧化碳的水溶液能导电,故二氧化碳是电解质
C.氯化钠溶液能导电,故氯化钠溶液是强电解质
D.氢氧化钠固体不导电,但氢氧化钠是电解质
8,下列反应中,属于离子反应的是 ( )
A.铁丝受热后伸入装有氧气的集气瓶中
B.CO气体在O2中燃烧
C.将CaCO3固体投入盐酸溶液中
D.将SO3气体通入水中,形成硫酸溶液
9.元素X是一种碱金属。下列关于X及其化合物的说法,不正确的是 ( )
A.无水硫酸盐的化学式是X2SO4
B.其氢氧化物是一种强碱
C.其单质是一种良好的还原剂
D.其单质可以由对应的氧化物与焦炭加热而制得
10.可用离子方程式H++OH-==H2O表示的化学反应是 ( )
A.CH3COOH+NaOH==CH3COONa+H2O
B.2HNO3+Mg(OH)2==Mg(NO3)2+2H2O
C.H2SO4+Ba(OH)2==BaSO4↓+2H2O
D.2HCl+Ba(OH)2==BaCl2+2H2O
二、选择题(共12小题,每小题2分,共24分,每题有1—2个答案)
11.下列关于焰色反应的叙述中,错误的是 ( )
A.鉴别Na2SO4和K2SO4通常用焰色反应
B.铁丝、铂丝、铜丝均可用来蘸取其他物质,进行焰色反应
C.焰色反应后,需用稀盐酸将铂丝洗净后再实验
D.应先将铂丝烧到与原来火焰颜色相同,再蘸取被检测物质
12.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是 ( )
A.Mg2+ B.Ca2+ C.Na+ D.Fe3+
13.下列各组离子,能在碱性溶液中大量共存的是 ( )
A.H+, Na+, Cl-, SO B.K+, Na+, SO, NO
C.Cu2+,K+, Cl-, NO D.Ca2+, K+, NO, SO
14.下列说法中,正确的是 ( )
A.干冰蒸发要吸收大量的热,这个变化是吸热反应
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.木炭需加热到一定温度才燃烧,木炭燃烧是吸热反应
D.用氢氧焰可焊接金属,主要是利用氢气和氧气化合时放出热量
15.下列物质中,不能与CO2反应的是 ( )
A.K2O2 B.RbHCO3 C.Na2O D.LiOH
16.下列离子反应方程式中,书写正确的是 ( )
A.钠与水反应:Na+H2O==Na++OH-+H2↑
B.氢氧化钠溶液与盐酸反应:NaOH+H+==Na++H2O
C.CO2通入Na2CO3溶液中:CO2+CO+H2O==2HCO
D.盐酸与NaHCO3溶液反应:H++HCO==CO2↑+H2O
17.下列各对物质间反应,其中既属于氧化还原反应,又属于离子反应的是 ( )
A.Zn+H2SO4(稀) B.NaCl+AgNO3 C.H2+O2 D.Na2O+H2O
18.下列四组溶液中,不用任何试剂就能够鉴别出来的是 ( )
A.石灰水、盐酸、Na2CO3溶液 B.食盐水、稀盐酸、BaCl2溶液
C.Na2CO3、Na2SO4、BaCl2三种溶液 D.盐酸、NaCl、AgNO3三种溶液
19.已知锌溶于稀硝酸中可发生如下反应:4Zn+10HNO3==4Zn(NO3)2+N2O↑+5H2O,该反应
中被还原的硝酸与未被还原的硝酸的质量比是 ( )
A.2∶5 B.1∶4 C.4∶1 D.5∶1
20.下列各组物质中,其性质按由强到弱的顺序排列的是 ( )
A.氢氧化物的碱性:Li、NA.K、RB.Cs
B.元素的金属性:Li、NA.K、RB.Cs
C.与水反应的剧烈程度:Li、NA.K、RB.Cs
D.阳离子的氧化性:Li+、Na+、K+、Rb+、Cs+
21.下列说法中,正确的是 ( )
A.1g钠投入到100g水中,所得溶液的质量为101g
B.1g表面被氧化的钠投入到100g水中,溶液的质量是101g
C.1g氧化钠投入到100g水中,溶液的质量是101g
D.1g过氧化钠投入到100g水中,溶液的质量是101g
22.将5g钠与3.2g硫迅速混合之后 ,放在石棉网上加热,反应后得到的固体物质是( )
A.Na2S、Na2O2 B.Na2S、S
C.Na2S、Na D.Na2S、Na2O
三、填空题:
23.(4分)有一包白色粉末,由NaCl、Na2SO4和Na2CO3中的一种或几种混合而成,取少
量白色粉末放入试管中,加适量的蒸馏水溶解,做以下实验:
(1)加入BaCl2溶液出现白色沉淀,则白色粉末中,可能含有的物质是______________
(2)继续向试管中加入稀盐酸,沉淀不消失再无其它现象,则白色粉末中,一定含有的
物质的是____________________一定不含有的物质是__________________。
(3)通过上述实验,还无法确定的物质是________________________________。
24.(5分)(1)NaOH溶液中混有少量的Na2CO3,除去的方法是________________,化学
反应方程式是________________________________________________。
(2)碱金属单质中密度最小的是_____________溶点最低的是___________,金属性最强
的是_____________ ____。
25.(14分)A.B.C三种固体物质的焰色反应为黄色,分别跟水发生化学反应均得物质D
的溶液;A跟水反应还有O2生成,B跟水反应还有H2生成,C跟水反应是化合反应:
(1)A为______________B为______________C为______________D为______________
(2)由B生成A的化学方程式__________________________________________。
(3)由A变为D的化学方程式__________________________________________。
(4)由B变为D的化学方程式__________________________________________。
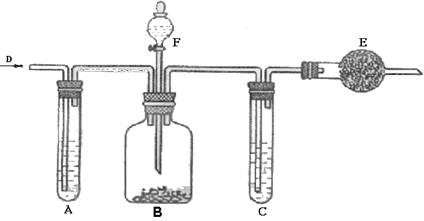
26.(10分)工业纯碱中常含有少量NaCl的杂质,可用下列装置测定纯碱中碳酸钠的质量分
数。如图所示,D处鼓入空气,A试管盛有NaOH溶液,F是盛有稀硫酸的分液漏斗,
B广口瓶中放的是含有NaCl的Na2CO3固体,C为盛有浓硫酸的试管,E为盛有碱石灰
的干燥管。
实验操作如下:
①检查装置的气密性。
②在干燥管内填满颗粒状碱石灰,称总重为W1g。
③称取一定量纯碱W2g,并放在广口瓶内。
④缓缓地加入稀硫酸到不产生气体为止。
|
试回答下列问题:
(1)鼓入空气的目的和装置E的作用分别是什么?_______________ ______
______________________________________________________________________。
(2)装置A的作用是__________________________________ __________________。
(3)装置C的作用是_____________________________________ _______________。
(4)碳酸钠质量分数计算式为________________________________ ___________。
(5)如撤去A则测定结果将_____________________________________ _________。
27.(4分)中和某一强酸需用去一定量KOH,若改用与KOH等质量的NaOH,反应后溶液呈
_________性;若改用与上述KOH等质量的Ba(OH)2,在反应后的溶液中滴加紫色石蕊
试液,则最终溶液显_________色。
28.(8分)有两种白色粉末A.B,进行如下实验:(1)加水时,A能溶于水而B不溶于水。
(2)加热至250℃,A能分解而B不能分解。(3)焰色反应,A呈现紫色而B无此现象。
(4)取相同质量的A.B分别与足量盐酸反应,在相同条件下能生成相同质量的气体,
且气体均为无色略带酸味,能使澄清石灰水变浑浊。
试判断A.B各为何物质,写出A.B与盐酸反应的离子方程式:
A__________________ _______,B______________ ______________;
A+盐酸__________________________ ________________;
B+盐酸______________________________________ ____。
四、计算题:(11分)
29.(5分)将70g过氧化钠和氧化钠的混合物跟98g水充分反应后,所得溶液质量分数为
50%,试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混合物中过氧化
钠和氧化钠的质量各为多少克?
30.(6分)取NaHCO3、Na2CO3、NaCl三者的混合物100g,加热到质量不再改变为止,剩
下残渣84.5g。求混合物中NaHCO3的质量分数。
高中学生学科素质训练
高一化学期中考试参考答案
一、选择题:
1、D 2、C 3、C 4、A 5、B 6、C 7、D 8、D 9、D 10、D
二、选择题:
11、B 12、C 13、BD 14、BD 15、B 16、CD 17、A 18、A 19、B
20、D 21、C 22、A
三、填空题:
23、(1)Na2SO4 Na2CO3 (2)Na2SO4 Na2CO3 (3)NaCl
24、(1)加入Ca(OH)2 Ca(OH)2+Na2CO3==CaCO3↓+2NaOH (2)Li Cs Cs
|
(2)2Na+O2 Na2O2 (3)2Na2O2+2H2O==4NaOH+O2↑ (4)2Na+2H2O==2NaOH+H2↑
26、(1)把广口瓶中产生的CO2全部排出;(2)吸收空气中的CO2 (3)吸收空气中的H2O
(4)![]() ×100%
(5)偏大 27、碱 红
×100%
(5)偏大 27、碱 红
28、KHCO3 CaCO3 HCO3-+H+==H2O+CO2↑ CaCO3+2H+==CO2↑+H2O+Ca2+
四、计算题:
29、解:设Na2O质量为x, Na2O2质量为100g-x
Na2O+H2O==2NaOH 2Na2O2+2H2O== 4NaOH + O2↑
62 80 156 160 32
x
![]() (100g-x)
(100g-x) ![]()
![]() (1')
(1')
|
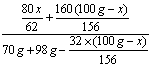 ×100%=50% (4') ∴x=31g ∴Na2O 31g Na2O2 69g
×100%=50% (4') ∴x=31g ∴Na2O 31g Na2O2 69g
30、解:2NaHCO3 Na2CO3+H2O+CO2↑
168 106 18+44 △m=62
m(NaHCO3) m(Na2CO3) △m'=100g-84.5g=15.5g
∴m(NaHCO3)=42g (4')
∴WNaHCO3=![]() ×100%=42%
(2')
答:略
×100%=42%
(2')
答:略