高一化学练习化学键
一、选择题(每小题有1或2个选项符合题意)
1.有下列电子层结构的各原子中最难形成离子的是
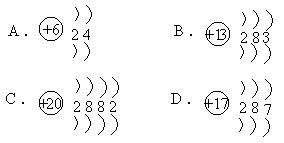
2.下列MgCl2的电子式中属于正确的是
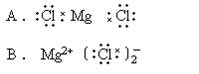
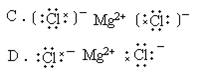
3.下列电子式中,正确的是
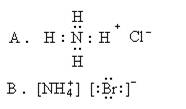
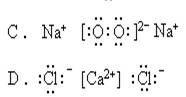
4.下列物质中属于共价化合物的是
A.Na2O2 B.NaHSO4 C. HNO3 D.I2
5.下列化合物中所有化学键都是共价键的是
A.NH4Cl B.NaOH C.CS2 D.CH4
6.下列物质中,含有非极性共价键的是
A.NH4Cl B.Na2O2 C.NaOH D.H2SO4
7.下列物质中,具有非极性键的离子化合物是
A.H2O2 B.MgF C.NaOH D.Na2O2
8.下列共价键中,极性最强的是
A.HF B.HCl C.HBr D.HI
9.下列分子是非极性分子
A.CO2 B.H2O C.PH3 D.BF3
10.关于化学键的下列表述中,正确的是
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.共价化合物中不含离子键
11.下列叙述正确的是
A.含有共价键的化合物一定是共价化合物 B.在气态单质分子中一定存在共价键
C.在共价化合物中一定存在共价键 D.只含有离子键的化合物才是离子化合物
12.下列关于分子的极性的说法中,不正确的是
A.极性分子中可能含有非极性键 B.非极性分子中可能含有极性键
C.极性分子中只含有极性键 D.非极性分子中只含有非极性键
13.下列各微粒半径依次增大的是
A.F、F-、Cl-、Br- B.Ca2+、K+、Mg2+、Al3+
C.Al3+、Al、Mg、K D.Ca2+、K+、Cl-、S2-
14.下列化合物中,阳离子与阴离子半径之比最大的是
A.LiCl B.NaBr C.KI D.CaF2
15.下列分子结构中的原子最外层电子都能满足8个电子稳定结构的是
A.光气(COCl2) B.六氟化硫 C.三氟化硼 D.四氯化碳
16.已知下列各组元素中,A、B 2种元素的原子序数,其中可组成AB2型离子化合物的是
A.6和8 B.12和17 C.11和8 D.13和17
17.下列能说明氯化氢是共价化合物事实的是
A.氯化氢不易分解 B.液态氯化氢不导电
C.氯化氢溶于水发生电离 D.氯化氢水溶液显酸性
18.下列性质中,可以证明某化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电
19.下列变化中,不需要破坏化学键的是
A.加热氯化铵 B.干冰气化 C.食盐溶于水 D.氯化氢溶于水
20.下列各组指定原子序数的元素,不能形成AB2型化合物的是
A.6和8 B.16和8 C.12和9 D.11和6
21.与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是
A.MgBr2 B.Na2S C.CCl4 D.KCl
22.某元素最高正价与负价绝对值之差为4,该元素的离子跟与其核外电子排布相同的离子形成的化合物是
A.K2S B.MgS C.MgO D.NaF
23.已知砷(As)是ⅤA族元素.下列对砷及其化合物的叙述中,正确的是
A.砷的原子半径大于磷的原子半径 B.五氯化砷分子中每个原子都满足8电子稳定结构
C.单质砷很容易跟氢气反应生成相应的气态氢化物 D.砷酸的酸性比磷酸的酸性弱
24.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是
A.b、a、d、c、e B.e、 b、a、 d、c
C.b、a、e、d、c D.c、 d、 e、 a、 b
25.X、Y是第二或第三周期的同周期元素,它们可以形成离子化合物XmYn,且离子均具有稀有气体的电子层结构,若X的原子序数为a,则Y的原子序数可能是
A.a+8-m-n B.a+16-m-n
C.a-m-n D.a-8+m+n
26.由ⅢA族元素与ⅣA族元素组成的阴离子,如下图所示:
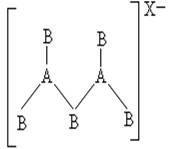
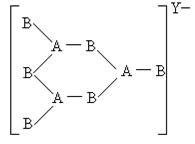
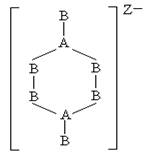
由此可知三种离子的电荷数X、Y、Z分别为
A.2,3,4 B.4,3,2 C.4,2,3 D.3,2,4
27.已知碳有三种常见的同位素:12C、13C、14C氧也有三种同位素:16O、17O、18O,由这六种核素构成的二氧化碳分子中,其式量最多有
A.18种 B.12种 C.7种 D.6种
28.某固体仅由一种元素组成,其密度为5.0g·cm-3,用X射线研究该固体的结构时得知:在边长为1×10-7cm的正方体中含有20个原子,则元素的相对原子质量最接近下列数据中的
A.32 B.120 C.150 D.180
二、填空与推断题
29.下列微粒都具备有10个电子,请写出它们的化学式.
(1)含一个原子核的二价阳离子________;(2)含两个原子核的分子________;
(3)含两个原子核的一价阴离子________;(4)含五个原子核的分子________;
(5)含五个原子核的一价阳离子________.
30.下列分子中,① HCL、②H2O2、③NH4Cl、 ④Na2O2、⑤KOH、 ⑥CO2、⑦CCl4、⑧CH2Cl2含有离子键的物质是________,含有极性键和非极性键的物质是________,由极性键构成的非极性分子是________,含有极性键的极性分子是________.
31.在 1~18号元素中,M、Y 2种元素组成的化合物,分子中共有38个电子,如M2Y化合物中有阴阳离子,则化合物的化学式是________.
32.X元素位于ⅡA族,原子核内有12个中子,它在最高价氧化物中质量分数是60%,Y元素的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是________,它是通过________键结合的.
33.A、B、C、D四种短周期元素,它们的原子序数依次增大.D的氢化物是H2D,在D的最高价氧化物中D的质量分数为40%,D原子核中质子数等于中子数;A和B的电子层数相同,A原子最外层电子数是次外层电子数的2倍;B的阴离子和C的阳离子的电子层结构与氖相同,常温下单质B是气体,且1mol B与H2完全反应时有2.408×1024个电子转移;单质C和B燃烧时产生淡黄色固体,此固体与AB2反应可得到B.
(1)这四种元素分别是________.
(2)AD2的电子式是________,C2B2的电子式是________.
34.有A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C、B与D分别是同族元素,B、D两元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质易溶于CS2中.试回答下列问题:
(1)B的名称是________,画出它的简单离子的结构示意图________.
(2)C与D所形成化合物的电子式为________它属于________化合物.
(3)写出两种均含四种元素的化合物相互反应放出气体的化学方程式________.
35.![]() Na2O在573K反应制得Na3NO4.问:
Na2O在573K反应制得Na3NO4.问:
![]()
(2)Na3NO4跟H2O以及CO2反应剧烈,且都能生成NaNO3,其化学方程式分别为:________、________.
(3)NaNO4也是存在的,且与水发生如下反应:NaNO4+H2O=NaNO3+H2O2,2H2O2=2H2O+O2↑
 则氧元素的化合价为________和________.
则氧元素的化合价为________和________.
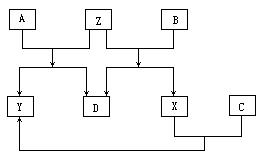
36.在下列转化关系中,已知D是短周期元素形成的单质,其他物质均是化合物,且A的相对分子质量小于B的相对分子质量.
根据以上物质间的转化关系(图中略去了转化中的部分物质):
(1)写出D、X、Y的化学式:D________;X________;Y________
(2)写出Z的电子式________;Z属________化合物
三、计算题
37.0.4g A的单质与盐酸充分反应放出0.02g氢气,B元素的阴离子结构与氩原子相同,它的气态氢化物水溶液是强酸.(1)推断A、B两种元素的名称及在周期表中的位置;
(2)用电子式表示A、B形成化合物的过程.
38.已知氯元素的近似原子量是35.5.氯有两种同位素35Cl和37Cl,那么在23.4g氯化钠中,37Cl的质量是多少克?
化学键答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | B | C | C | CD | B | D | A | AD | AD |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | CD | BC | D | A | B | B | D | B | D |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | ||
| A | AC | AD | C | A | B | C | C |
二、填空与推断题
29. ![]()
30.③④⑤,②,⑥⑦,①②⑧
31. Na2S
32. MgF2,离子
33. (1)C、O、Na、S (2)![]() Na+ [
Na+ [![]() ]2-Na+
]2-Na+
34.(1)氧元素 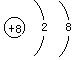 (2)Na+ [
(2)Na+ [![]() ]2-Na+ 离子
]2-Na+ 离子
(3)NaHSO4+NaHSO3=Na2SO4+SO2↑+H2O
35.(1)[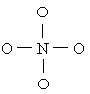 ]3- (2)Na3NO4+H2O=NaNO3+2NaOH
]3- (2)Na3NO4+H2O=NaNO3+2NaOH
Na3NO4+CO2=NaNO3+Na2CO3 (3)-1、-2
36.(1)O2、Na2CO3、NaOH (2)Na+[![]() ]2-Na+ 离子
]2-Na+ 离子
三、计算题
37.(1)钙,4、ⅡA;氯,3、ⅦA;(2)Ca∶+2 ![]() Ca2+
Ca2+
![]()
38. 3.7g