高一化学练习碳族元素
(本卷共100分,练习时间90分钟)
成绩
相对原子质量: H 1 C 12 N 14 O 16 Na 23 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 I 127 Hg 201 Br 80 I 127
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.关于碳族元素的说法正确的是
A.原子半径由上到下逐渐变小 B.各元素形成的化合物均以正四价最稳定
C.各元素最高氧化物均易溶于水 D.硅和锗均可作半导体材料
2.下列气态氢化物中稳定性最强的是
A.HCl B.SiH4 C.PH3 D.H2S
3.在反应SiO2+3C![]() SiC+2CO↑中,氧化剂与还原剂的物质的量之比为[ ]
SiC+2CO↑中,氧化剂与还原剂的物质的量之比为[ ]
A.1∶3 B.3∶1 C.2∶1 D.1∶2
4.下列说法中,正确的是
A.以共价键相结合形成的化合物种类最多的元素是碳
B.某物质只含有一种元素,则该物质一定是纯净物
C.大气污染物中,能与人体血红蛋白结合而引起中毒的气体只有CO
D.金刚石、石墨、C60都是碳的同素异形体,性质完全相同
5.下列说法正确的是
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃可得原硅酸
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸酸性比碳酸强
D.二氧化硅是酸性氧化物,不溶于任何酸
6.下列物质中不能与二氧化硅作用的是
A.纯碱 B.苛性钠 C.氢氟酸 D.水
7.将空气和CO2按5∶1体积比混合后跟足量的赤热焦炭充分反应,若反应前后的温度相同,则在所得气体中,CO的体积分数为(假设空气中氮气、氧气的体积比为4∶1,其他成分可忽略不计)
A.29% B.33.3% C.50% D.100%
8.下列属于同种物质的是
A.干冰和冰 B.石英和水晶 C.玻璃与二氧化硅 D.水玻璃和玻璃
9.根据下列事实:
(1)在醋酸钠中加入磷酸溶液有醋酸气味产生(2)在无水碳酸钠固体上滴上醋酸会出现气泡
(3)硅酸钠溶液通入CO2气体有白色胶状沉淀产生,判断四种酸的酸性由强到弱的顺序是 [ ]
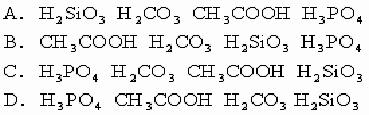
10. 高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是
A.7、2 B.5、4 C.6、3 D.3、6
二、选择题(本题包括12小题,每小题3分,共36分。每小题有一至二个选项符合题意,少选扣2分,多选、错选均不给分)
11.近年来,科学家发现一种新分子,它具有空心的类似足球状结构,化学式为C60,下列说法正确的是
A.C60是一种新型化合物 B.C60和石墨都是碳的同素异形体
C.C60在纯氧中充分燃烧只生成唯一产物CO2 D.C60的摩尔质量为720
12.下列说法中,错误的是
A.硅酸是不挥发性酸,它与食盐反应生成氯化氢
B.氢氟酸能和玻璃发生化学反应,所以氢氟酸要存放在塑料瓶中
C.水玻璃有粘性,所以要存放在带橡胶塞的试剂瓶中
D.烧碱液能腐蚀玻璃并生成硅酸钠,所以烧碱液要存放在带橡胶塞的玻璃瓶中
13.下列离子反应方程式书写正确的是 [ ]
![]()
B.往硅酸钠水溶液中滴加稀盐酸:![]()
![]()
D.往碳酸氢钠溶液中加硫酸氢钠溶液:![]()
14.地球表面的大气中二氧化碳的含量不断增加的后果是
A.产生酸雨 B.产生温室效应 C.破坏臭氧层 D.对植物产生毒害作用
|
|
对上述两个反应的下列叙述中,错误的是
A.两个反应都是置换反应 B.反应②不是置换反应
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
16.将过量的CO2分别通入①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液,最终溶液中有白色沉淀析出的是
A.①②③④ B.②④ C.①②③ D.②③④
17.下面有关硅的叙述中,正确的是
A.硅的非金属性比碳弱,只有在高温下才能跟氢气起化合反应
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是最重要的半导体材料
18.二氧化硅是酸酐的原因是
A.它溶于水得相应的酸 B.它对应的水化物是可溶性强酸
C.它与强碱溶液反应只生成盐和水 D.它是非金属氧化物
19.能证明碳酸比硅酸酸性强的实验事实是
|
B.高温下能发生反应 Na2CO3+SiO2======Na2SiO3+CO2↑
C.CO2溶于水生成碳酸,而SiO2却不溶于水
D.CO2通入Na2SiO3溶液中有胶状沉淀生成
20.证明生石灰中既混有石英、又混有石灰石的正确方法是
A.加入过量盐酸,观察是否有气泡冒出
B.加入过量烧碱溶液,观察是否有固体溶解
C.加热至高温、观察是否有气泡冒出,是否有硅酸钙生成
D.先加过量盐酸搅拌,观察是否有不溶物剩余及气泡出现;若有不溶物则滤出,投入到氢氧化钠溶液中看其是否溶解
21. 已知新发现的114号元素X,它的原子核外的最外层上有4个电子,下列有关叙述正确的是
A.X有稳定的气态氢化物XH4 B.X的最高价的氧化物化学式是XO2
C.X为非金属元素 D.X的单质能导电
22.有10 g不纯CaCO3样品与足量盐酸作用后生成4.44 g CO2,且溶液中残留难溶物质。则对于此样品中是否存在①MgCO3 ②K2CO3 ③SiO2杂质的判断正确的是
A.肯定含①③,不含② B.肯定含①③,可能含②
C.肯定含②③,不含① D.肯定含②③,可能含①
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
三、填空题(本大题共29分)
23.(3分)硅元素在地壳中的含量占第____ 位,仅次于____ ,硅主要以___ 形式存在。
24.(10分)如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入在表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
Ⅰ.可供选择的试剂:
A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
Ⅱ.可选用的操作:
①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
| 编号 | 粉末状混合物 | 所加试剂 | 主要操作 |
| (1) | SiO2(CaCO3) | ||
| (2) | CaCO3(SiO2) | ||
| (3) | NaCl(SiO2) | ||
| (4) | SiO2(Fe2O3) | ||
| (5) | SiO2(H2SiO3) |
25.(8分)阅读下列材料,回答有关的问题。
锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡离子有强还原性,+4价铅元素的化合物有强氧化性。例如:Sn2+还原性比Fe2+还原性强。PbO2的氧化性比Cl2氧化性强。
(1)写出下列反应的化学方程式
①氯气跟锡共热: ;
②氯气跟铅共热: ;
③二氧化铅跟浓盐酸共热: 。
(2)能说明Sn2+还原性比Fe2+还原性强的离子方程式是 。
26.(8分判断下列说法的正误,并加以解释。在括号中填正误,横线上填解释。
(1)二氧化硅溶于水显酸性。( ) 。
(2)二氧化碳通入水玻璃可得到硅酸。( ) 。
|
(3)已知高温时有CaCO3+SiO2=====CaSiO3+CO2↑ ,所以硅酸的酸性比碳酸强。( )
。
(4)因为二氧化硅属于酸性氧化物,所以它不溶于任何酸。( ) 。
四、推断题(6分)
27.有三种元素X、Y、Z,都是短周期元素,X和Y位于周期表的同一周期,可形成共价化合物XY2,此化合物在常温下呈气态。Z和X为同族元素,Z和Y可形成共价化合物ZY2,此化合物在常温下为固态。X的单质跟ZY2反应可生成Z的单质。Z的一种晶体是很好的半导体材料。根据以上事实,判断X、Y、Z各为什么元素,写出有关方程式。
五、计算题(9分)
28.已知硅和铝都能与碱溶液反应,反应的离子方程式分别是:
Si+2OH-+H2O====SiO![]() +2H2↑
+2H2↑
2Al+2OH-+2H2O====2AlO![]() +3H2↑
+3H2↑
现有一铁、硅、铝的混合物13 g,当与足量盐酸反应时,生成标准状况下的氢气的体积为 11.2 L ;若将等质量的混合物与足量的氢氧化钠溶液反应时,生成的氢气在标准状况下也是11.2 L。求原混合物中各成分的质量。
附加题(10分)
原硅酸H4SiO4的分子结构为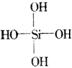 ,它在水溶液里不稳定,可以通过分子间的脱水缩聚成网状的大分子,这样的缩聚硅酸可用通式[SiO2·(H2O)n]表示,若n=1.5,缩聚物则为SiO2·(H2O)1.5即H6Si2O7。分析某缩聚硅酸的含硅量(质量分数)为40.6%,按HxSiyOz的形式写出此缩聚硅酸的组成_____________ ,推测其分子结构式为______
,它跟NaOH反应时生成可溶性的Na2SiO3,写出该化学反应的方程式_______
。
,它在水溶液里不稳定,可以通过分子间的脱水缩聚成网状的大分子,这样的缩聚硅酸可用通式[SiO2·(H2O)n]表示,若n=1.5,缩聚物则为SiO2·(H2O)1.5即H6Si2O7。分析某缩聚硅酸的含硅量(质量分数)为40.6%,按HxSiyOz的形式写出此缩聚硅酸的组成_____________ ,推测其分子结构式为______
,它跟NaOH反应时生成可溶性的Na2SiO3,写出该化学反应的方程式_______
。