高一化学卤素元素
一、选择题(本题共20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1.下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是 ( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化(MCE00)
2.由于“智力工程”的推行,“碘盐”已开始进入千家万户。 下列关于“碘盐”的叙述中,正确的是 ( )
A. “碘盐”宜密封保存 B. “碘盐”就是“I2+NaCl”
C. “碘盐”就是NaI D. 使用“碘盐”时宜高温煎炒
3.能正确说明HF、HCl、HBr、HI的性质依次递变规律的是 ( )
A. 生成时的条件由难到易 B. 颜色逐渐加深
C. 水溶液的酸性依次增强 D. 稳定性依次增强
4.把石蕊试液滴加到氯水中,出现的现象是 ( )
A. 蓝色石蕊试液变红色 B. 红色石蕊试液变蓝色
C. 石蕊试液变黑色 D. 石蕊试液颜色消褪
5.常温下与NaOH溶液能反应,且只生成一种盐的是 ( )
A. F2 B. Cl2 C. I2 D. S
6.下列反应属于置换反应的是 ( )
A. Cu+2FeCl3=CuCl2+2FeCl2 B. SO2+2H2S=2H2O+3S
C. Cl2+C2H6 ![]() C2H5Cl+HCl D. 2KClO3+I2
C2H5Cl+HCl D. 2KClO3+I2 ![]() Cl2+2KIO3
Cl2+2KIO3
7. 在下列有关卤素单质与重要化合物的应用上错误的是 ( )
A. 用漂白粉作消毒剂 B. 工业上用食盐水与浓硫酸反应制盐酸
C. 用萤石制氢氟酸 D. 碘化银用于人工降雨
8. 将氟气通入NaCl溶液中,可以得到的是 ( )
A. 氯气和氟化钠 B. 氧气和氢氟酸 C. 金属钠和氟化氢 D. 氯化钠和氟化钠
9. 在反应8NH3+3Cl2=6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比是 ( )
A. 3∶1 B. 1∶3 C. 1∶1 D. 3∶8
10. 制备氯化氢气体,下列方法中可行的是 ( )
①NaHSO4+MnCl2(固)共热 ②浓H2SO4+浓HCl共热
③浓H2SO4+KCl(固)共热 ④H2SO4(浓)+NaCl+MnO2(固)共热
A. 只有①③ B. ①②③ C. 只有③ D. 全部
11. 下列物质的水溶液跟热的浓碱液混合后,不能实现3X2+6KOH![]() 5KX+KXO3+3H2O反应的是
(
)
5KX+KXO3+3H2O反应的是
(
)
A. F2 B. Cl2 C. Br2 D. I2
12. 下列叙述正确的是 ( )
A. HCl气体的水溶液是盐酸,故HCl气体能使干燥的蓝色石蕊试纸变红
B. KI溶液久置显黄色,是因I-被氧化所致
C. 能使湿润的碘化钾淀粉试纸变蓝的气体,一定是氯气
D. 任何元素在反应中由化合态变为游离态的过程均是发生了氧化反应
13. 已知3Br2+6FeCl2=4FeCl3+2FeBr3,则112 mL Cl2(标准状况)通入10 mL 1mol/L的FeBr2溶液中,发生反应的离子方程式书写正确的是 ( )
A. Cl2+2Br-=2Cl-+Br2
B. Cl2+2Fe2+=2Cl-+2Fe3+
C. 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D. 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
14.下列说法正确的是 ( )
A. 氢氟酸能腐蚀玻璃,它是强酸
B. 淀粉溶液中滴入KI溶液,再加FeCl3溶液会变蓝
C. 氟比氯、溴、碘更活泼,氟气能把它们从卤化物溶液中置换出来
D. Cl2的水溶液能导电,所以Cl2是电解质
15.为了除去氯化钾溶液中含少量K2SO4杂质得到纯的KCl,需用的试剂为 ( )
①BaCl2 ②Ba(NO3)2 ③K2CO3 ④Na2CO3 ⑤HCl ⑥HNO3
A. ①或② B. ①③⑤ C. ②③⑥ D. ②③⑤
16.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。下列说法中正确的是 ( )
A.二氧化氯是强氧化剂 B.二氧化氯是强还原剂(MCE01)
C.二氧化氯是离子化合物 D.二氧化氯分子中氯为负1价
17.将某种金属卤化物和浓硫酸在烧瓶里加热后,可得无色卤化氢气体,则该金属卤化物是 ( )
A. 氟化物 B. 氯化物 C. 溴化物 D. 碘化物
18.以下的实验及说明,正确的是 ( )
A. CuCl2+H2S=CuS↓+2HCl (硫的非金属性比氯强)
B. 2NaCl(固)+H2SO4(浓) ![]() Na2SO4+2HCl↑(氯的非金属性比硫强)
Na2SO4+2HCl↑(氯的非金属性比硫强)
C. H2S+Cl2=2HCl+S↓(氯的氧化性比硫强)
D. 3Na2S+2FeCl3=6NaCl+2FeS↓+S↓(氯的氧化性比硫弱)
19.在浓度为C mol/L AgNO3溶液a mL中,加入一定量的pH=1的盐酸时, 恰好将溶液中的Ag+完全沉淀,此时得到pH=2的溶液100 mL(反应前后溶液体积变化忽略不计),则C值应是 ( )
A. 0.002 C. 0.011 C. 0.11 D. 0.22
20.已知:2![]() +Cl2=Br2+2
+Cl2=Br2+2![]() ,5Cl2+I2+6H2O=2HIO3+10HCl,
,5Cl2+I2+6H2O=2HIO3+10HCl,![]() +5Cl-+6H+=3Cl2+3H2O,则氧化性强弱顺序排列正确的是
( )
+5Cl-+6H+=3Cl2+3H2O,则氧化性强弱顺序排列正确的是
( )
A. ![]() >
>![]() >
>![]() >Cl2
B.
>Cl2
B. ![]() >Cl2>
>Cl2>![]() >
>![]()
C. ![]() >
>![]() >Cl2>
>Cl2>![]() D. Cl2>
D. Cl2>![]() >
>![]() >
>![]()
二、填空题(本题包括6小题,共30分)
21. (5分)做过碘升华实验的烧杯壁上粘有碘应用________________洗涤; 久置石灰水的试剂瓶上的白色斑迹应用_________________洗涤; 碘中含有少量碘化钾除去的方法是___________________;粗盐易潮解是因含有_______________________等杂质;用萤石和浓硫酸共热制HF应在____________________中进行。
22.(4分)我国工业上大多数采用立式隔膜电解槽来电解食盐水制烧碱和氯气, 电解槽中用________作阳极,用________阴极,设置石棉隔膜的作用是_______________________
____________________________________________________,电解食盐水总的离子方程式为________________________________________________________。
23.(5分)在A、B两试管中分别加入1 mL NaCl溶液和NaI溶液, 再往两支试管中滴加1 mL CCl4和几滴溴水。摇匀后,在A试管中的CCl4层显______色,这是因为____________
_______________________________;B试管中的CCl4层显______色,这是因为__________
_______________________________。该反应的离子方程式是___________________________
_______________________________。
24.(4分)在AgF溶液中通入氯气,发生以下反应:
AgF+Cl2+H2O ─→ AgCl+AgClO3+HF+O2 (未配平)
(1) 若Cl2的系数为a,则AgF的系数为________;
(2) 若AgClO3的系数为b,O2的系数为c,则AgCl的系数为__________。
25.(5分)下图每一方框中的字母代表一种反应物或生成物:(MCE00)
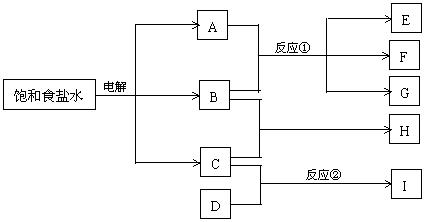
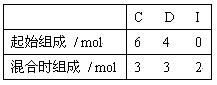
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
(1) 物质H的分子式是_____________。
(2) 反应①的化学方程式是__________________________________________________。
(3) 反应②的化学方程式(须注明反应条件)是___________________________________。
26.(7分)今有H2和Cl2的混合气100 mL(标准状况下),其中一种气体体积为45 mL ,另一种气体体积为55 mL。光照两种气体发生反应后恢复到标准状况下,气体的体积变为______ mL。为证明反应后气体中有H2或Cl2剩余,使气体通过100 mL水,并使剩余气体干燥后,恢复到标准状况。
⑴ 若剩余气体为_______ mL,证明有____________剩余;
⑵ 若溶液有_________性,证明有_____________剩余;
⑶ 由于气态的HCl极易溶于水,可用测定溶液的pH值并和计算值核对,即可知有H2或Cl2剩余,这方法是否正确?__________,其理由是_________________________________
______________________________________________________________________。
三、计算题(10分)
27. 将a g H2与b g Cl2合成制得HCl气体,把反应所得的混合气体用足量NaOH溶液充分吸收。求:
⑴ 剩余气体的质量;
⑵ 混合气体与NaOH溶液反应所得NaCl的质量。
答 案
1.C 2. A 3.C 4.D 5.A 6.D 7.B 8.B 9.B 10.B 11.A 12.B 13.B 14.B 15.B 16.A 17.B 18.C 19.B 20.C
21. (每空1分)酒精; 盐酸; 升华; MgCl2、CaCl2; 铅皿
22. (每空1分)石墨; 铁丝网; 其一是防止两极产生的H2和Cl2混合反应发生爆炸,其二是防止Cl2与NaOH反应,多耗电能和产品不纯; 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
23. (每空1分)棕; Br2不与NaCl作用而溶于CCl4; 紫; Br2氧化I-生成I2, 溶于CCl4; Br2+2I-=2Br-+I2
24. (每空2分)(1)2a (2)5b+4c
25. (5分)(1)HCl(1分) (2) Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(3) ![]() (化学方程式1分,反应条件1分)
(化学方程式1分,反应条件1分)
26. (每空1分)100 (1)10; H2 (2)氧化; Cl2 (3)不正确; 因为Cl2溶于水时对HCl的pH值影响极小
27. H2+Cl2=2HCl; HCl+NaOH=NaCl+H2O; Cl2+2NaOH=NaCl+NaClO+H2O
⑴ 若H2与Cl2恰好完全反应(a∶b=1∶35.5),则无剩余气体。 (1分)
n(NaCl)=n(HCl)=2n(Cl2)=![]() mol
mol
m(NaCl)=58.5 g / mol×![]() mol =
mol =![]() g
(1分)
g
(1分)
⑵ 若Cl2过量(a∶b<1∶35.5=,过量的氯气将与NaOH溶液反应,故无剩余气体。(1分)
反应的氯气为![]() mol,生成HCl为a mol,
(1分)
mol,生成HCl为a mol,
(1分)
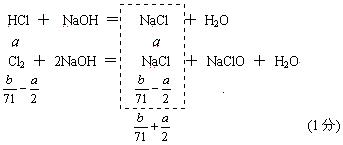
m(NaCl)=(![]() ) mol×58.5 g / mol =
) mol×58.5 g / mol = ![]() (1分)
(1分)
⑶ 若H2过量(a∶b>1∶35.5),
反应的氢气为![]() mol,生成的氯化氢为
mol,生成的氯化氢为![]() mol
(1分)
mol
(1分)
剩余的氢气质量为 ![]() (1分)
(1分)
n(NaCl)=n(HCl)=2n(Cl2)=![]() mol
(1分)
mol
(1分)
m(NaCl)=58.5 g / mol×![]() mol =
mol =![]() g
(1分)
g
(1分)