【高一化学模拟试题】
全卷可能用到的相对原子质量:
Na:23 Cl:35.5 O:16 Na:23 S:32 Fe:56 Mg:24
一. 选择题(本题包括5小题,每小题2分,共10分)每小题只有一个选项符合题意。
1. 原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是![]() ,则其中子数与电子数之差是( )
,则其中子数与电子数之差是( )
A. 77 B.
2. 下列物质中属于同素异形体的是( )
A. ![]() 和
和![]() B.
B. ![]() 和
和![]() C.
C. ![]() 和
和![]() D.
D. ![]() 和
和![]()
3. 下列化合物中阳离子半径与阴离子半径比值最小的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
4. 下列各粒子:① ![]() 、
、![]() 、
、![]() ;②
;② ![]() 、
、![]() 、
、![]() ;③
;③ ![]() 、
、![]() 、
、![]() ;④
;④ ![]() 、
、![]() 、
、![]() 具有相同质子数和电子数的正确一组是( )
具有相同质子数和电子数的正确一组是( )
A. ①②③ B. ①②④ C. ②③④ D. ①③④
5. 为了保护臭氧层,可采取的有效措施是( )
A. 减少二氧化硫的排放量 B. 减少含铅废气的排放量
C. 减少氟氯代烷的排放量 D. 减少二氧化碳的排放量
二. 选择题(本题包括15小题,每小题3分,共45分)每小题有一个或两个选项符合题意。若正确答案只有一个选项,多选时,这题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要错选一个,这小题就为0分。
6. 下列能说明元素R一定为氧族元素的是( )
A. R为非金属元素,其氧化物对应水化物分子式为![]()
B. R的单质与![]() 化合成
化合成![]()
C. R的单质与铝能够化合生成![]()
D. R的氢化物的水溶液呈酸性
7. 对于第n电子层,若它作为原子的最外层,则容纳的电子数最多与n—1层的相同;当它作为次外层,则其容纳的电子数比n+1层上电子最多能多10个,则第n层为( )
A. L层 B. M层 C. N层 D. 任意层
8. 下列关于化学键的说法正确的是( )
A. 组成单质的分子内一定含有共价键
B. 由非金属元素组成的化合物不一定是共价化合物
C. 非极性键只存在于双原子单质分子中
D. 不同元素组成的多原子分子里的化学键一定为极性键
9. X、Y是第2或第3周期中的两种元素,它们可形成离子化合物![]() ,且离子均有稀有气体原子的电子层结构。若X的原子序数为a,则Y的原子序数不可能是( )
,且离子均有稀有气体原子的电子层结构。若X的原子序数为a,则Y的原子序数不可能是( )
A. ![]() B.
B.
![]()
C. ![]() D.
D.
![]()
A. 全部是FeS B.
有![]() 、S和Fe
、S和Fe
C. 有Fe和FeS D. 有S和FeS
11. 下列物质的变化过程中,有共价键明显被破坏的是( )
A. ![]() 升华 B.
升华 B.
![]() 颗粒被粉碎
颗粒被粉碎
C. ![]() 溶于水得盐酸 D.
从
溶于水得盐酸 D.
从![]() 中闻到刺激味
中闻到刺激味
12. 在![]() 的反应中,被氧化与被还原的物质的质量比为( )
的反应中,被氧化与被还原的物质的质量比为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
13. 二氧化硫气体的排放是形成酸雨的主要原因。二氧化硫主要来源于含硫燃料的燃烧。为了减少酸雨的形成,在含硫较多的煤中掺入一定量的生石灰或石灰石,此煤燃烧后硫元素的主要存在形式是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
14. 最新科技报导:前不久,美国夏威夷联合天文中心的科学家发现了新的氢微粒。这种氢微粒是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考。对于这种氢微粒,下列说法错误的是( )
A. 它一定含有3个中子
B. 它比普通氢分子多一个氢原子核
C. 它的组成可以用![]() 表示
表示
D. 可以推测它的化学性质与![]() 不同
不同
15. 某元素同位素的单质![]() ,极易形成
,极易形成![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A. 此同位素中含有中子数为![]()
B. 此同位素形成的离子中含有的电子数为![]()
C. 此单质中含有的质子数为![]()
D. 该同位素一个原子的质量约是![]()
16. 在臭氧发生装置中装入氧气![]() ,经反应
,经反应![]() ,最后气体体积变为
,最后气体体积变为![]() (体积均在标准状况下测定),则混合气体的密度是( )
(体积均在标准状况下测定),则混合气体的密度是( )
17. 下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是( )
A. X原子的反应中得到的电子数比Y原子在反应中得到的电子数少
B. 气态氢化物溶于水后的酸性,X比Y强
C. X的最高正价比Y的最高正价大
D. X单质能与Y的氢化物反应生成Y单质
18. 两种大气污染物![]() 和
和![]() 在一定条件下可以发生如下反应:
在一定条件下可以发生如下反应:![]()
![]()
![]() ,在体积为VL的密闭容器中通入
,在体积为VL的密闭容器中通入![]() 和
和![]() ,反应后容器内硫原子和氧原子个数比为( )
,反应后容器内硫原子和氧原子个数比为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
19. 除去二氧化硫中混有的三氧化硫,所用试剂是( )
A. 水 B. 石灰水
C. 酸性![]() 溶液 D.
饱和亚硫酸氢钠溶液
溶液 D.
饱和亚硫酸氢钠溶液
20. 某种![]() 、
、![]() 、
、![]() 的混合物,测得其中含硫24%,则混合物中氧元素的质量分数为( )
的混合物,测得其中含硫24%,则混合物中氧元素的质量分数为( )
A. 24.5% B. 41.5% C. 66% D. 无法判断
三. 填空题:(本题包括3小题,共19分)
21. 有若干克某金属,其原子核内共有![]() 个中子,同质量的该金属和稀硫酸反应共有
个中子,同质量的该金属和稀硫酸反应共有![]() 电子发生转移,生成
电子发生转移,生成![]() 个阳离子,这些阳离子共有
个阳离子,这些阳离子共有![]() 个质子,则该金属摩尔质量为
,原子核内有
个质子,
个质子,则该金属摩尔质量为
,原子核内有
个质子,
个中子,其原子组成符号为 。
22. 制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、![]() 、
、![]() 等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 >
>![]() 、
、![]() ;第三周期
;第三周期![]()
![]() >
> 。
>
> 。
(2)化合物的毒性:![]() ;
;![]()
![]() ;CS2
CO2;
;CS2
CO2;![]()
![]() (填“>”“=”或“<”)。于是科学家们开始把注意力集中在含F、Cl的化合物上。
(填“>”“=”或“<”)。于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知![]() 的沸点为
的沸点为![]() 的沸点为
的沸点为![]() )终于诞生了,其他类似的还可以有 。
)终于诞生了,其他类似的还可以有 。
(4)然而,这种制冷剂造成了当今的某一环境问题是 。但求助于周期表中元素及其他合物的 变化趋势来开发制冷剂的科学思维方法是值得借鉴的(填写字母,多选扣分)① 毒性,② 沸点,③ 易燃性,④ 水溶性,⑤ 颜色
A. ①②③ B. ②④⑤ C. ②③④
23. 现有酚酞试液、溴水、氨水、氢硫酸等溶液。
(1)若要证明![]() 有氧化性,可选用的试剂是
,实现现象是 ;反应方程式为 。
有氧化性,可选用的试剂是
,实现现象是 ;反应方程式为 。
(2)若要证明![]() 有还原性,可选用的试剂是 ,实现现象是
;反应方程式为
。
有还原性,可选用的试剂是 ,实现现象是
;反应方程式为
。
(3)若要证明![]() 是酸性氧化物,可选用的试剂是 ,操作方法是 ;实验现象是
。
是酸性氧化物,可选用的试剂是 ,操作方法是 ;实验现象是
。
四. 推断题:(本题包括2小题,共12分)
24. ![]() 离子化合物的阴、阳离子的电子层结构相同,每摩尔
离子化合物的阴、阳离子的电子层结构相同,每摩尔![]() 分子中含有
分子中含有![]() 电子,根据下列反应:
电子,根据下列反应:
①
![]()
②
![]()
③
![]() (Z有漂白作用)
(Z有漂白作用)
(1)写出下列物质的化学式:AB2 ,X ,Y ,Z
。
(2)用电子式表示AB2的形成过程 。
(3)写出反应②的化学方程式 。
25. 今有原子序数依次增大的A、B、C、D、E、F六种主族元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水。D和E各有如下表的电子层结构。在一般情况下,B元素不能与A、C、E元素的游离态化合而成化合态的B。
| 元素 | 最外层电子数 | 次外层电子数 |
| D |
|
|
| E |
|
|
按要求填空:
(1)各元素的元素符号分别为:A 、B 、C 、D
、E 、F 。
(2)比较D、E两者氢化物的稳定性 > (化学式)
(3)A与C两元素的最高价氧化物对应的水化物反应的离子方程式是 。
(4)把A的单质投入重水中,反应生成的氧化产物的化学式为 ,还原剂为 ,反应的离子方程式 。
五. 实验题:(本题10分)
26. 浓硫酸与木炭粉在加热条件下反应的化学方程式为:
![]() (浓)
(浓)![]()
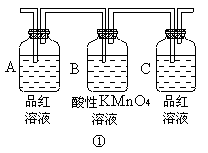
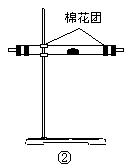
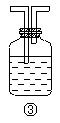
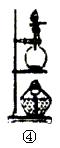
(1)试用如图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): →
→ → 。
(2)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(3)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。
(4)装置③中所盛溶液是 ,可验证的产物是 。
六. 计算题:(本题4分)
27. ![]() 的
的![]() 溶液吸收
溶液吸收![]() (标况),求所得溶液中溶质的成分及物质的量是多少?
(标况),求所得溶液中溶质的成分及物质的量是多少?

【试题答案】
一. 选择题:
| 1 D | | 3 B | 4 B | |
二. 选择题:
| 6 BC | 7 B | 8 B | 9 B | | 11 CD | | 13 D |
| | | 16 B | 17 D | 18 B | 19 D | 20 B |
三. 填空题:
21. 摩尔质量![]() , 12 个质子, 12 个中子,原子组成符号
, 12 个质子, 12 个中子,原子组成符号![]() 。
。
22.
(1)![]() 、
、![]() ;
;![]() 。
。
(2)![]() ;
;![]() ;
;![]()
(3)其他类似的还可以有![]() 。
。
(4)环境问题是破坏臭氧层。 A 变化趋势。
23.
(1)可选用的试剂是氢硫酸,实现现象是 淡黄色浑浊 ;反应方程式为![]()
![]() 。
。
(2)可选用的试剂是 溴水 ,实验现象是 溴水褪色 ;反应方程式为![]()
![]() 。
。
(3)可选用的试剂是 酚酞、氯水 ,操作方法是 将氯水中滴加酚酞后通入SO2气体 ;实现现象是 红色褪成无色 。
四. 推断题:
24.
(1)AB2
CaCl2 ,X![]() ,Y
,Y![]() ,Z
,Z![]() 。
。
(2)用电子式表示AB2的形成过程![]()
(3)反应②的化学方程式![]()
25.
(1)A![]() 、B
、B![]() 、C
、C![]() 、D
、D![]() 、E
、E![]() 、F
、F![]() 。
。
(2)稳定性![]() (化学式)
(化学式)
(3)离子方程式是![]()
(4)氧化产物![]() ,还原剂
,还原剂![]() ,离子方程式
,离子方程式![]()
五. 实验题:
26.
(1)连接顺序: 4 → 2 → 1 → 3 。
(2)A瓶作用 检验SO2的存在 ,B瓶作用 吸收SO2、,C瓶作用 检验SO2是否吸收完全 。
(3)②中药品![]() ,确证产物
,确证产物![]() ,理由 白色粉末变为蓝色 。
,理由 白色粉末变为蓝色 。
(4)③溶液是 澄清的石灰水 ,验证产物 CO2 。
六. 计算题:
27.
解:守恒法:由于![]() ,所以产物为
,所以产物为![]() 、
、![]() 两种。
两种。
设生成![]()
![]() ,
,![]()
![]() 。
。
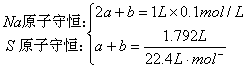
解得:![]()
【试卷分析】
本次期中检测的知识包括:元素周期律和元素周期表以及氧族元素的前2节的内容,试卷长度为90分钟,难度中等,难 : 中 : 易=![]() 。但有些题目较为灵活,如18、22、23、26题等等。同时考查了同学们知识应用能力,实验能力以及一些解题技巧。
。但有些题目较为灵活,如18、22、23、26题等等。同时考查了同学们知识应用能力,实验能力以及一些解题技巧。