高一(下)化学期末考试试题(B卷)
一、选择题
1.下列事实或名词与环境污染无关的是( )
A.温室效应 B.酸雨 C.光化学烟雾 D.潮汐
2.原子半径最接近的数值是( )
A.n×10-4m B.n×10-6m
C.n×10-8m D.n×10-10m
3.1992年,我国取得的重大科技成果之一是发现了三种元素的新的同位素,其中一种是![]() Hg,它的中子数是( )
Hg,它的中子数是( )
A.80 B.128 C.208 D.288
4.下列化合物中,其阳离子和阴离子具有相同的电子层数的是( )
A.NaCl B.MgBr2 C.KCl D.LiF
5.按元素核电荷数递增的顺序,下列各项递减的是( )
A.卤素原子的半径 B.卤素气态氢化物的稳定性
C.卤素阴离子的还原性 D.卤素单质的熔点和沸点
6.下面叙述中正确的是( )
A.碘易升华,所以要保存在铁盖旋紧的试剂瓶中
B.液溴应保存在磨口玻璃塞试剂瓶中,并加少量水进行水封
C.能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气
D.碘易溶于酒精,所以用酒精从碘水中萃取碘
7.下列叙述中,正确的是( )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
8.某溶液含有较多的Na2SO4和少量的Fe2(SO4)3.若用该溶液制取芒硝,可供选择的操作有:①加适量H2SO4溶液;②加金属Na;③结晶;④加过量NaOH溶液;⑤加强热脱结晶水;⑥过滤.正确的操作步骤是( )
A.②⑥③ B.④⑥①③
C.④⑥③⑤ D.②⑥①③⑤
9.下列各组离子,在强碱性溶液中可以大量共存的是( )
A.I-、CO32-、Cl-、S2- B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、PO43- D.SO32-、HCO3-、NO3-、F-
10.已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是( )
A.铍的原子半径大于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气
11.氢化钠(NaH)是一种白色的离子化合物.已知NaH与水反应可放出氢气.则下面叙述正确 的是( )
A.NaH与水反应后溶液呈酸性
B.NaH中氢离子被还原成H2
C.NaH中氢离子的半径大于Li+的半径
D.反应中水是氧化剂,而NaH是还原剂
12.能正确表示下列反应的离子方程式是( )
A.将Cl2通入溴化铁溶液: 2Br-+Cl2=2Cl+Br2
B.FeS和稀硝酸反应: FeS+2H+=Fe2++H2S↑
C.硫酸和氨水反应: H++OH-=H2O
D.碳酸钡和稀硫酸反应: BaCO3+2H+=Ba2++CO2↑+H2O
13.重水A和普通水B分别是足量的金属钠反应,下列叙述正确的是( )
A.A、B质量相等时,产生气体的体积在同温、同压下相等
B.A、B质量相等时,产生气体的质量相等
C.A、B的物质的量相等时,产生气体的体积在同温、同压下相等
D.A、B的物质的量相等时,产生气体的质量相等
![]() 14.将10L空气通过臭氧发生器,有部分氧气发生反应:3O2
2O3,得到9.7L混合气体,则得到臭氧的体积(同条件)是( )
14.将10L空气通过臭氧发生器,有部分氧气发生反应:3O2
2O3,得到9.7L混合气体,则得到臭氧的体积(同条件)是( )
A.1L B.0.5L C.0.3L D.0.6L
15.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温、常压下,11.2LN2含有的分子数为0.5NA
B.在常温、常压下,1mol Ne含有的原子数为NA
C.71 g Cl2所含原子数为2NA
D.在同温、同压时,相同体积的任何气体单质所含的原子数相同
16.向饱和的亚硫酸钠溶液中通入过量的氯气,生成的钠盐可能有( )
A.1种 B.2种 C.3种 D.4种
17.在短周期元素组成的化合物中,若其原子个数比为1∶2,设两种元素的原子序数分别为a 和b,则下列对a和b可能关系的概括中,正确的是( )
①a+b=15 ②a=b+6 ③a=b-5 ④a+b=22
A.①③ B.①③④ C.①②③④ D.①②④
18.已知下列热化学方程式:
Zn(固)+![]() O2(气)=Zn(固)+Q1,Hg(液)+
O2(气)=Zn(固)+Q1,Hg(液)+ ![]() O2(气)=HgO(固)+Q0 则Zn(固)+HgO(固)=Hg(液)+ZnO(固)+Q中的Q值为( )
O2(气)=HgO(固)+Q0 则Zn(固)+HgO(固)=Hg(液)+ZnO(固)+Q中的Q值为( )
A.Q2-Q1 B.Q1+Q2 C.Q1-Q2 D.-(Q1+Q2)
19.用足量的过氧化钠分别与水、二氧化碳、盐酸、硫酸发生反应,若生成的气体体积相同( 同温、同压)时,则得到的产物NaOH、Na2CO3、NaCl、Na2SO4的物质的量之比为( )
A.2∶1∶2∶1 B.1∶2∶1∶2 C.4∶2∶2∶1 D.1∶2∶2∶1
20.将气体①HCl、②SO2、③H2S、④Cl2、⑤CO2分别通入水中,均于同条件下达到饱和,所得溶液的物质的量浓度排列顺序正确的是( )
A.⑤>④>③>②>① B.①>②>③>④>⑤
C.④>⑤>③>②>① D.⑤<③<④<②<①
二、实验题
21.下列说法不正确的是(填写标号) .
A.用托盘天平进行称量,一般可准确到0.01g.
B.容量瓶上标有温度和容量,使用前要检查是否漏水.
C.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛.
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢注入浓硫酸.
E.用四氧化碳、苯或汽油均可以从溴水中萃取溴.
![]()
![]() 22.实验室用NH3还原CuO的方法测定Cu的近似原子量,反应方程式为:2NH3+3CuO
22.实验室用NH3还原CuO的方法测定Cu的近似原子量,反应方程式为:2NH3+3CuO
N2+3Cu+3H2O.试回答:
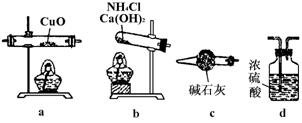 |
(1)如果实验选用测量反应物CuO和生成物H2O的质量〔m(CuO)和m(H2)〕时,请用图1 所示的仪器设计一个简单的实验方案.
图1
仪器连接的顺序(用字母表示,仪器可重复使用)为 ;d中浓硫酸的作用是 ;实验完毕时观察到a中的现象是 .
(2)计算Cu的原子量的表达式为 .
(3)下列情况将使测定结果偏大的是 .
(a)CuO未全部还原成Cu (b)CuO受潮 (c)CuO中混有Cu
(4)如果仍采用图1的仪器装置,其它实验方案可选用测定的物理量有 .
(a)m(Cu)和m(CuO) (b)m(N2)和m(H2O) (c)m(Cu)和m(H2O)
三、填空题
23.配平下列化学方程式,并回答有关问题:
□Cu2S+□HNO3——□Cu(NO3)2+□NO↑+□S+□H2O
反应中还原剂是 ,电子转移的数目是 .
24.各取一定量的NaHCO3和NH4HCO3,分别加热到300℃使之完全分解,在该温度和相同压强下收集到的气体体积之比是1∶6,则原来NaHCO3和NH4HCO3的物质的量之比是 .
 |
25.图2中每一个方格表示一种反应物或生成物(反应中的水以及部分反应中生成的常温下呈气态的物质均已略去).已知D是一种盐,焰色反应呈浅紫色.
图2
(1)A是 ,B是 G是 (用化学式表示).
(2)E+G→C的化学反应方程式为 .
(3)A、B、C三种物质反应的物质的量之比为 .
四、计算题
26.硫酸银的溶解度较小,25℃时,每100g水中仅溶解0.836g硫酸银.
(1)25℃时,在烧杯中放入3.12g硫酸银固体,加入200g水,经充分溶解后,所得溶液的体积 仍为200mL.计算溶液中SO42-的物质的量浓度.
(2)在上述烧杯中加入多少升0.0268mol/LBaCl2溶液,才能使原溶液中SO42-离子 浓度降至0.01mol/L?(写出计算过程)
高一(下)化学期末考试试题(B卷)参考答案
一、1.D 2.D 3.B 4.C 5.B 6.B 7.AD 8.B 9.AC 10.AC 11.CD 12.A 13 .C 14.D 15.BC 16.C 17.C 18.C 19.A 20.B
二、21.B、C、E
22.(1)b、c、a、c、d,吸收未反应的NH3,防止空气中的水进入e;固体 由黑变红
(2)18m(CuO)/m(H2O)-16
(3)a、c
(4)a、c
23.3、16、6、4、3、8、Cu2S、12e
24.1∶2
25.(1)KCl、KClO3、H2SO3
![]() (2)Cl2+H2SO3+H2O 2HCl+H2SO4
(2)Cl2+H2SO3+H2O 2HCl+H2SO4
(3)5∶1∶3
三、26.(1)0.0268mol/L
(2)0.217L