高一(下)期末试卷化学试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷 1~2页,第Ⅱ卷3~6页,共6页。卷面总分100分。考试时间90分钟。
可能用到的相对原子质量:H:1 C:12 O:16 Zn:65 S:32 Si:28 Ca:40
第Ⅰ卷(选择题共48分)
本卷包括16小题。每小题3分,共48分。每小题后的4个选项中只有一个选项符合题目要求。
1、下列物质中,不属于同素异形体的是( )
A.O2和O3 B.12C和14C
C.白磷和红磷 D.金刚石和石墨
2、下列物质中既含有非极性键,又含有极性键的是( )
A.H2SO4 B.NaClO
C.H2O2 D.NaCl
3、下列物质都具有漂白性,其中漂白原理和其他几种不同的是( )
A.H2O2 B.O3
C.SO2 D.HClO
4、Z元素的某元素离子Zn-,其核外有x个电子,该元素的质量数为A,则原子核内含有的中子数为( )
A.A-x-n B.A+x+n
C.A+x-n D.A-x+n
5、下列各项比较正确的是( )
A.稳定性:NH3<H2S<HCl
B.酸性:HClO4>H2SO4>H2SiO3
C.金属性:Na>Mg>Ca
D.原子半径:S<Cl<Al
6、能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.高温下SiO2与碳酸盐反应生成CO2
C.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
D.CO2通入可溶性硅酸盐中析出硅酸沉淀
7、实验室制取氢气和氧气可使用相同的原理的是( )
A.收集原理 B.净化装置
C.反应原理 D.发生装置
8、现有下列五组物质之间的转化,其中不可能通过一步反应实现的是( )
①SiO2→Na2SiO3
②CuSO4→CuCl2
③SiO2→H2SiO3
④SO2→H2SO4⑤Na2CO3→NaOH
A.②③④ B.③
C.②③④⑤ D.①②
9、为除去SO2气体中少量的HCl及水蒸气,需用的一组试剂是( )
A.饱和NaHSO3溶液和浓H2SO4
B.AgNO3溶液和碱石灰(CaO、NaOH混合物)
C.NaHCO3溶液和碱石灰
D.饱和NaOH溶液和浓H2SO4
10、下列反应可用化学方程式SO2+Br2+2H2O=H2SO4+2HBr表示的有( )
A.把浓H2SO4与溴化氢混合加热得到的红棕色混合气体通入水中
B.把溴化氢气体通入亚硫酸溶液中
C.把SO2气体通入NaBr与盐酸的混合溶液
D.把Na2SO3溶液加入到溴水中
11、现已发现的116号元素(即该元素原子的核电荷数为116),已知它是氧族元素,则下列叙述错误的是( )
A.其原子最外层有6个电子
B.其最高价氧化物的水化物是强酸
C.X是金属元素
D.不能形成稳定的气态氢化物
12、X、Y、Z是三种短周期元素,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同。又知三元素最外层电子数之和为14,而质子数之和为28。则三种元素有可能是( )
①N、O、S ②C、N、P
③Be、O、S ④N、P、F
A.②③ B.③④
C.①④ D.①②
13、X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径;Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径;X、Y、Z三种元素原子序数的关系是( )
A.Z>Y>X B.Y>X>Z
C.Z>X>Y D.X>Y>Z
14、下列离子方程式正确的是( )
A.往烧碱溶液中通入少量CO2:CO2+OH-=HCO3-
B.过氧化钠投入含H218O的水中:2Na2O2+2H218O=4Na++4OH-+18O2↑
C.向小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3+2H2O+CO32-
D.石英与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O
15、为方便某些化学计算,有人将98%浓硫酸表示成下列形式,其中合理的是( )
①H2SO4·1/9H2O ②H2SO4·H2O
③H2SO4·SO3 ④SO3·10/9H2O
A.② B.③④
C.②④ D.①④
16、将一定量的锌与100mL 18.5mol/L浓H2SO4充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况下),将反应后的溶液释释至1L,测得溶液的c(H+)=0.1mol/L,则下列叙述中错误的是( )
A.气体A中SO2和H2的体积比为4:1
B.反应中共转移电子为3mol
C.反应中共消耗锌97.5g
D.气体A为SO2和H2的混合物
第Ⅱ卷(非选择题共52分)
本卷共6道题
17、(9分)通过实验证明KClO3的成分里含有钾、氧和氯三种元素,完全下列实验报告。

18、(12分)I为了比较硫与碳的非金属性的强弱,某同学想通过比较两种元素的最高价氧化物对应的水化物的酸性强弱来验证硫与碳的非金属性的强弱,采用了下图中的甲、乙装置:
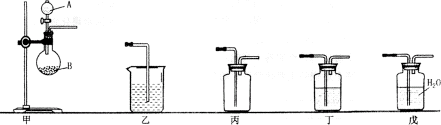
(1)仪器A中应盛放的药品是___________,仪器B中应盛放的药品是________,装置乙中应盛放的药品是___________。
(2)B中发生反应的离子方程式为:______________________________;
在装置乙中观察到的现象是:_______________________________。
(3)该实验能证明硫与碳非金属性强弱的理论依据是:________________________________________。
Ⅱ实验室用MnO2和浓盐酸反应制取氯气,如果使用上述甲、乙、丙、戊五种装置,请回答下列问题:
(4)上述装置图中还缺少的实验用品是_______________________。
(5)配备实验用品后,进行实验,B中发生反应的离子方程式为:_______。
(6)若要制得纯净的氯气,上述装置的连接顺序是(用甲、乙、丙、丁、戊表示连接的先后顺序)__________________,装置丁中盛放的试剂是________________。
19、(9分)A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物,这些单质、化合物之间存在如下图所示关系,反应条均件未注明,回答下列问题:
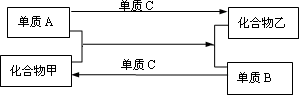
下列(1)~(3)中的A不在同一主族。
(1)若A为ⅢA族元素,则A是__________,B为________,C为______。
(2)若化合物甲在常温、常压下为液态,则组成化合物甲的元素所属类别为_________(填金属或非金属),单质A与化合物甲反应的化学方程式为: ________________。
(3)若化合物乙为氧化物,则化合物甲所属物质类别为___________(填配、碱、盐、氧化物、氢化物),单质A与化合物甲反应的化学方程式为:____________________。
20、(7分)为了验证氢气在空气中点燃发生化学反应生成物除水以外,还有过氧化氢。某学生设计了如下两个对比实验:
(1)在点燃的氢气火焰上方用湿润的淀粉碘化钾试纸检验,发现淀粉碘化钾试纸变蓝;
(2)在点燃的酒精灯火焰上方用湿润的淀粉碘化钾试纸检验,发现淀粉碘化钾试纸不变蓝(已知酒精的分子式为C2H5OH);
通过以上两个对比实验请回答下列问题:
(1)试写出以上两个燃烧的主要化学反应的化学方程式:
_______________________________________________________;
_______________________________________________________。
(2)试说明上述实验能证明氢气在空气中燃烧的生成物中含有氧化氢的理由_______________________________;写出氢气与空气中氧气发生反应生成过氧化氢的化学方程式及过氧化氢使湿润的淀粉碘化钾变蓝的离子反应方程式:
_______________________________________________________;
_______________________________________________________。
21、(6分)为了有效控制酸雨,我国政府已批准了《酸雨控制区和二氧化硫污染控制区方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
![]()
分析数据,回答雨水样品的pH变化的原因是(用化学方程式表示)
_________________________________________________________。
(2)研究结果表示:高烟囱可以有效地降低地表面SO2浓度。在20世纪的60年代~70年代的10年间,由发电厂排出的SO2增加了35%,但由于建筑高烟囱的结果,地面浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
(3)你认为减少酸雨产生的途径可采用的措施是________________。
①少用煤作燃料; ②把工厂烟囱造高;
③燃料脱硫; ④在已酸化的土壤中加石灰; ⑤开发新能源
A.①②③B.②③④⑤
C.①③⑤D.①③④⑤
22、(9分)把13g含有SiO2的CaCO3固体在高温下加热到质量不再减少为止,冷却后称重为8.6g。回答下列问题:
(1)生成的CO2在标准状况下的体积为_________L。
(2)求原物质中含SiO2的质量。
(3)试通过计算确定混合物发生的化学反应并写出发生反应的化学反应方程式。
答案:第一卷、1---5 BCCDB 6---10 DABAA 11---16 BAADDA
提示:
5、稳定性:H2S<NH3≈HCl 金属性:Na>Ca>Mg 原子半径:Al>S>Cl
7、Zn+H2SO4=ZnSO4+H2↑
2KClO3![]() 2KCl+3O2↑H2和O2都可用排水法收集。
2KCl+3O2↑H2和O2都可用排水法收集。
8、SiO2+2NaOH=Na2SiO3+H2O
CuSO4+BaCl2=BaSO4↓+CuCl2
SiO2+2NaOH=Na2SiO3+H2O
Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
SO2+H2O2=H2SO4
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
10、B、C中不发生反应,D中发生反应Na2SO3+Br2+H2O=Na2SO4+2HBr
14、A、2OH-+CO2=CO32-+H2O
B、2Na2O2+2H218O=4Na++2OH-+218OH-+O2↑
C、Ca2++HCO3-+OH-=CaCO3↓+H2O
15、100g溶液中有1mol H2SO4和![]() mol H2O
mol H2O
16、参加反应的H2SO4物质的量为
![]()
生成气体的物质的量为![]()
若只生成SO2,则![]()
故生成的气体成分既有SO2又有H2,设SO2、H2的物质的量分别为x、y
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2x x
Zn+H2SO4=ZnSO4+H2↑
y y
![]()
第二卷、17、
18、(1)稀H2SO4;Na2CO3(或可溶性碳酸盐);澄清石灰水
(2)CO32-+2H+=H2O+CO2↑;澄清石灰水变浑浊
(3)由H2SO4制H2CO3即由强酸制弱酸,S的最高价氧化物对应水化物的酸性强,故S的非金属性比C强。
(4)铁圈、石棉网、酒精灯
(5)MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
(6)甲、戊、丁、丙、乙;浓H2SO4
19、(1)Al;H2 ;Cl2
(2)非金属;2F2+2H2O=4HF+O2
(3)氧化物或氢化物;SiO2+2C ![]() Si+2CO↑或O2+H2S
Si+2CO↑或O2+H2S![]() 2H2O+S(其它合理答案均可)
2H2O+S(其它合理答案均可)
提示:
A+甲→B+乙属置换反应,置换反应有四种情况
(1)金属置换出金属
Fe+CuSO4=FeSO4+Cu
Na+KCl ![]() NaCl+K
NaCl+K
2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
(2)金属置换出非金属
Zn+H2SO4=ZnSO4+H2↑
2Na+2H2O=2NaOH+H2↑
2Mg+CO2![]() 2MgO+C
2MgO+C
2Mg+SO2![]() 2MgO+S
2MgO+S
2Mg+SiO2![]() 2MgO+Si
2MgO+Si
(3)非金属置换出非金属
2F2+2H2O=4HF+O2
Cl2+2HBr=2HCl+Br2
O2+2H2S ![]() 2H2O+2S
2H2O+2S
Cl2+H2S=2HCl+S
2C+SiO2![]() Si+2CO
Si+2CO
Si+4HF=SiF4↑+2H2↑
3Cl2+8NH3=N2+6NH4Cl
C+H2O ![]() CO+H2
CO+H2
(4)非金属置换出金属
H2+CuO ![]() Cu+H2O
Cu+H2O
C+CuO ![]() Cu+CO
Cu+CO
20、(1)2H2+O2![]() 2H2O
2H2O
C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
(2)由实验可知,如果H2燃烧只生成水,
则不可能使湿润的淀粉碘化钾试纸变蓝,
现试纸变蓝,说明生成物中含有氧化性物质——H2O2;
H2+O2![]() H2O 2H2O2+2I-=I2+2OH-
H2O 2H2O2+2I-=I2+2OH-
21、(1)2H2SO3+O2=2H2SO4
(2)不可取,因为SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害。
(3)C
22、(1)![]()
(2)n(CO2)=n(CaCO3)=0.1mol
m(CaCO3)=10.0g
m(SiO2)=3.0g
(3)若只发生反应SiO2 + CaCO3![]() CaSiO3+CO2↑
CaSiO3+CO2↑
0.1mol 0.1mol 0.1mol
则SiO2和CaCO3总质量为0.1mol×(60g/mol+100g/mol)=16.0g
若只发生反应CaCO3![]() CaO+CO2↑
CaO+CO2↑
则CaCO3质量为10.0g
∵10.0g<13g<16.0g
∴发生的反应有CaCO3+SiO2![]() CaSiO3+CO2↑
CaSiO3+CO2↑
CaCO3![]() CaO+CO2↑
CaO+CO2↑