高一第一学期期末考试化学试题
(时间:90分钟 分值:100分)
请注意:①本试卷分为第I卷(选择题1—2页)和第Ⅱ卷(非选择题3—8页)。
②答题时,把第I卷(选择题)的答案写在第3页选择题答题栏内,第Ⅱ卷(非选择题)的答案
直接写在试题的有关空白处。
③可能用到的数据:原子的相对质量:
H: 1 C: 12 N: 14 O: 16 Na: 23 Cl : 35.5 K: 39
第I卷 (选择题 共44分)
一、选择题(本题包括11小题,每小题只有一个选项符合题意,每小题4分,共44分)
1.在国际单位制中,物质的量的基本单位是 B
(A) kg (B) mol (C) L (D) g·mol-1
2.下列化合物中不能用金属单质与氯气反应制得的是 C
(A) ZnCl2 (B) CaCl2 (C) FeCl2 (D) FeCl3
3.下列关于漂白粉的叙述,错误的是 B
(A) 可用于杀菌消毒 (B) 它的有效成分是氯化钙
(C) 可用来漂白某些有色物质 (D) 工业上常用氯气和消石灰制得
4.金属在空气中长久放置,最后变成一种白色粉末,白色粉末是 B
(A) NaOH (B) Na2CO3 (C) Na2O (D) Na2O2
5.在同温同压下,1 mol H2 与10g Cl2 的体积关系为 A
(A) H2>Cl2 (B) H2 < Cl2 (C) H2 = Cl2 (D) 不能确定
6.下列关系正确的是 C
(A) 还原性: Na>K (B) 离子半径: Na+>K+
(C) 热稳定性: Na2CO3>NaHCO3 (D) 熔点: Na<K
7.在氯水中加入KI溶液后振荡,再加入CCl4振荡后静置,观察到的现象是 B
(A) 液体呈现红色 (B) 液体分两层,上层无色,下层紫红色
(C) 液体分两层,上层紫红色,下层无色 (D) 液体分两层,上下均为紫红色
8.下列反应的离子方程式能用H++OH-=H2O表示的反应是 D
(A) 醋酸与氢氧化钠溶液 (B) 氢氧化铜和盐酸
(C) 氢氧化钡和稀硫酸 (D) 澄清石灰水和稀盐酸
9.设NA为阿伏加德罗常数,下列说法不正确的是 A
(A) 标准状况下,22.4 L氢气中含NA个氢原子
(B) 18g水中含有的电子数为10NA
(C) 1mol Cl2与金属Na完全反应,可以得到2NA个电子
(D) 在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
10.下列各组离子能在强酸性溶液中大量共存的是 C
(A) Na+、K+、I-、HCO3- (B) Mg2+、Na+、ClO-、I-
(C) K+、Cu2+、Cl-、SO42- (D) Mg2+、Ca2+、Cl-、CO32-
11.为实现我国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知溶液中IO3-可以与I-发生如下的反应:
IO3-+5 I-+6H+=3I2+3H2O
据此反应,可用试剂和一些生活中常见的物质进行试验,证明在食盐在存在着IO3-。可供选用的物质是:①自来水 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤蔗糖 ⑥食醋 ⑦白酒。进行上叙实验时必须使用的物质是 B
(A) ①③ (B) ③⑥ (C) ②④⑥ (D) ①②④⑤⑦
第一学期期末考试
高 一 化 学 试 题
试 卷 总 得 分 栏(由教师填写)
| 题 号 | 一 | 二 | 三 | 四 | 总 成 绩 |
| 得 分 |
选择题答题栏(由学生自己填写)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答 案 |
第II卷(非选择题 共56分)
注意事项:1. 第II卷共6页, 用钢笔或圆珠笔直接答在试卷上。
2. 答卷前将密封线内的项目写清楚
| 得分 | 评卷人 |
二、本大题包括4小题,共21分
12.(6分)氟、氯、溴、碘的原子结构的相似点是________________________。在化学反应中,它们的原子都容易________电子,都是活泼的________________元素,它们的原子半径依次___________,元素的非金属性依次___________,其单质的氧化性依次__________。
13.(4分)配制250mL 0.5mol/L NaOH溶液,在下列仪器:A 托盘天平 B 量筒 C烧杯 D 玻璃棒 E 漏斗F 500mL容量瓶 G 药匙 H 250mL容量瓶 I 胶头滴管 J 坩埚 中,不需要用到的仪器有__________
14.(5分)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为____________,物质的量之比为____________,原子总数之比为____________,质量之比为____________,密度之比为____________。
15.(9分)在如下反应:MnO2 + 4HCl = MnCl2 + H2O + Cl2↑中,浓 HCl做___________剂,其中的_______元素被_______,发生_____________反应;MnO2做___________剂,发生_____________反应。若有7.1gCl2生成,则被氧化的还原剂的质量为___________g。请在方程式上标出电子转移的情况。
| 得分 | 评卷人 |
三、本大题包括4小题,共26分
16.(5分)在烧杯中加入水和煤油(密度:0.85 g/cm3)各50 mL,温度计测量其温度后将一粒金属钠(密度:0.97 g/cm3)投入烧杯中。
(1)观察到的有关钠的现象可能是___________
(A) 钠在水层中四处游动
(B) 钠停留在煤油层中没有明显现象
(C) 钠在煤油的液面上四处游动
(D) 钠在煤油与水的界面处四处游动并有在煤油层中上、下跳动的现象
(2)根据你已有的知识推断:反应完毕后用温度计测量溶液的温度,结果是_______
(A) 温度升高 (B) 温度降低 (C) 温度不变
若仅根据上面的实验现象,可对该化学反应做出的结论是________________________________________________________
(3)写出实验过程中反应的离子方程式________________________________________________________
17.(6分)有四种化合物W、X、Y、Z,它们的焰色均呈黄色,且它们之间有如下的反应转化关系:
![]() W
W ![]() X+H2O+CO2↑ Z+CO2
X+H2O+CO2↑ Z+CO2
![]() X+O2↑
X+O2↑
![]() Z+H2O
Z+H2O
![]() Y+O2↑
X+Ca(OH)2
Y+O2↑
X+Ca(OH)2 ![]() Y+CaCO3
Y+CaCO3
根据以上反应判断W、X、Y、Z的化学式:
W Y Z
18.(6分)在失去标签的盛有AgNO3、HBr、Na2CO3、和CaCl2四种无色溶液的试剂瓶上分别贴有A、B、C、D标号,它们两两混合产生的现象如下表:
| A | B | C | D | |
| A | — | 无色气体 | 白色沉淀 | 白色沉淀 |
| B | 无色气体 | — | 无明显现象 | 淡黄色沉淀 |
| C | 白色沉淀 | 无明显现象 | — | 白色沉淀 |
| D | 白色沉淀 | 淡黄色沉淀 | 白色沉淀 | — |
则A为 ;B为 ;C为 。
19.(9分)某同学设计了实验,要用如下的仪器和试剂证明使色素褪色的物质究竟是不是Cl2。
| |||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||
|
|
|
| ||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
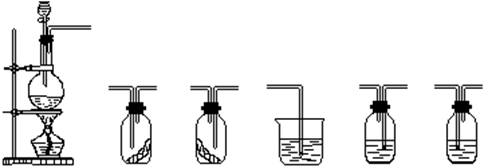
试回答:
(1)按气体从左向右流向将各装置依次连接起来(填接口标号):
a 接 接 接 接 接 接 接 接 接
(2)A装置烧瓶中发生反应的离子方程式:
(3)D装置的作用是 E装置的作用是
F装置的作用是
(4)C瓶中的现象是 ,B瓶中的现象是
以上事实说明起漂白作用的物质是
| 得分 | 评卷人 |
四、本大题包括2小题,共6分
20.(3分)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1 g/cm)中,所得盐酸的密度为1.18g/cm3。
求:(1)该盐酸中氯化氢的质量分数
(2)取这种盐酸10mL,稀释到1.18L,所得的稀盐酸的物质的量浓度
21.(3分)将50L(标况,下同)二氧化碳和氧气的混合气体通过装有一足量Na2O2的装置(设二氧化碳全部被吸收)后气体体积为45L。
求:(1) 在混合气体中二氧化碳的体积
(2) 参加反应的Na2O2的质量