高一化学第六章单元检测
以下题目请全部填写在答题卷上
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Ca-40 Fe-56
一、选择题(每小题只有1个正确选项)
1、向三氯化铁和氯化钡的混和溶液中通入二氧化硫气体,有白色沉淀生成,
此沉淀是
A、硫化亚铁 B、硫磺
C、亚硫酸钡 D、硫酸钡
2、常温下能在密闭的铁制容器中盛放的试剂是
A、稀硫酸 B、浓硫酸
C、浓盐酸 D、硫酸铜溶液
3、SO2是常见的大气污染物之一,我国规定空气中SO2含量不超过0.02mg/L。下列措施
中不能够减少SO2排放量的是
A、用天然气代替煤碳做民用燃料 B、提高热能利用率
C、燃煤中加入生石灰后使用 D、硫酸厂采取措施提高尾气的吸收率
4、锌钡白是一种白色颜料,其主要成分是难溶于水的锌盐和钡盐,它们是
A、ZnCO3和BaCl2 B、ZnCl2和BaCO3
C、ZnS和BaSO4 D、ZnCO3和Ba(NO3)2
5、石膏[CaSO4·2H2O]加热到150~170℃时,会失去部分结晶水而生成熟石膏,其分子式
为[2CaSO4·H2O],则通过加热每生成1摩尔熟石膏失去水的物质的量为
A、1moL B、1.5moL
C、2moL D、3moL
二、选择题(每小题有1至2个正确选项)
6、下列各组物质不是互为同素异形体的是
A、15N和14N B、O2和O3
C、金刚石和石墨 D、H2O和H2O
7、下列哪些事实能够说明硫的非金属性弱于氯
A、常温下硫为固体,氯气为黄绿色气体
B、铁与硫反应生成硫化亚铁,铁与氯气反应生成氯化铁
C、硫化氢加热容易分解,氯化氢受热较稳定
D、硫不溶于水,而氯气能溶于水
8、过氧化氢俗称双氧水,它是一种液体,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为贮存、运输、使用的方便,工业上常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H202),该晶体具有Na2CO3和H202的双重性质。下列物质不会使过碳酸钠晶体失效的是
A、MnO2 B、H2S
C、稀盐酸 D、NaHCO3
9、下列反应的离子方程式正确的是
A、碳酸钙跟稀盐酸反应:CO32-+2H+==CO2↑+H2O
B、氯气跟水反应:Cl2+H2O==H++Cl - + HClO
C、稀硫酸跟氢氧化钡溶液反应:Ba2++SO42-==BaSO4↓
D、过氧化钠跟水反应:2Na2O2+2H2O==4Na++4OH-+O2↑
10、在100g物质的量浓度为18moL/L、密度为1.8g/cm3的浓硫酸中,加入100g蒸馏水,
所得硫酸溶液的物质的量浓度为
A、9moL/L B、大于9moL/L
C、小于9moL/L D、以上都不对2
11、工业上从含硒废料中提取硒的方法是用H2SO4和NaNO3处理废料,获得亚硒酸和少量
硒酸,再与盐酸共热,硒酸即转化为亚硒酸(2HCl+H2SeO4 = H2SeO3+Cl2+H2O),再通
入SO2于亚硒酸的溶液中,单质硒析出,据此下列叙述正确的是
A、H2SeO4的氧化性强于Cl2 B、亚硒酸的氧化性强于亚硫酸
C、SeO2还原性强于SO2 D、1moL SO2柝出1moL Se
12、现有1 L含SO3为30%的发烟硫酸(密度为1.95克/毫升),要把它稀释为浓度为95%的
硫酸,需加入水的体积约为
A、120mL
B、180mL
C、240mL D、300mL
13、市场上销售的84消毒液,其商品说明中有如下叙述:
(1)本品为无色液体,呈碱性 (2)使用时需加水稀释
(3)可对餐具、衣物进行消毒 (4)可漂白浅色物质
据此推测其有效成分可能是
A、过氧化钠 B、碳酸钠
C、次氯酸钠 D、高锰酸钾
14、吸进人体的氧有2%转化为氧化性极强的活性氧,这种活性氧能加速人体的衰老,被称
之为“生命杀手”,科学家尝试用Na2SeO3消除活性氧,则Na2SeO3的作用是
A、作为氧化剂 B、作为还原剂
C、既是氧化剂又是还原剂 D、既不是氧化剂又不是还原剂
15、某元素的硫酸盐的分子量为a,同价态的该元素的碳酸盐的分子量为b,则该元素的化
合价数值为
![]() A、
A、
![]() B、
B、 ![]()
C、 ![]() D、
D、
三、填空题
16、过氧化氢(H2O2)可作采矿废液消毒剂,如消除采矿废液中的氰化物,发生的化学反
应方程式如下(已配平):KCN+H2O2+H2O = A+NH3 回答下列问题:
生成物A的化学式为 ;该反应 (填“是”或“不是”)氧化还原反应。
17、同主族元素其性质相似。例如,硫化物性质类似于氧化物;它也可以分为酸性硫化物
和碱性硫化物;也存在氧化性或还原性;互相间也能发生反应。例如:Na2S+CS2===Na2CS3(硫代碳酸钠),完成下列反应方程式:
(1)Na2S+As2S5 →
(2)Na2S+SnS2 →
(3)Na2S2+SnS →
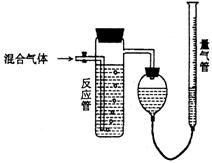 18、业上测量SO2、N2、O2混合气体中SO2含量的
18、业上测量SO2、N2、O2混合气体中SO2含量的
装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写分子式)
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)
(3)反应管内的碘的淀粉溶液也可以用 代替(选填一种物质名称)
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为.
(填仪器编号)a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四、计算题
19、有一废水样品10L,经分析得知游离(Cl2)的浓度为0.012mol/L,废水中的H+浓度
为0.001mol/L。已知Cl2和Na2SO3在溶液中有如下反应:Cl2+Na2SO3+H2O=Na2SO4+2HCl
现欲除去其中的游离氯,并成为中性溶液,问:
(1)需加入浓度0.1mol/L的Na2SO3溶液多少升?(2)需加入固体烧碱多少克?
20、在0.15L某浓度的浓硫酸中加入铜片,加热使之反应,待铜片全部溶解后,冷却定容
为1.00L,取出0.05L稀释后的溶液,加入足量的铁粉,充分反应后,收集到1.68L(标准状况)气体。将残留固体经过过滤、洗涤、干燥、冷却后称量,质量减轻了3.96g。根据上述数据计算原硫酸溶液的物质的量浓度。
高一化学第六章单元检测答题卷
班级 姓名 得分
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 |
二、选择题
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
三、填空题
16、 ; 。
17、 (1)
(2)
(3)
18、(1) (2) (3) (4) (5)
四、计算题
19、
20、
高一化学第六章单元检测参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 | D | B | B | C | D |
二、选择题
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | AD | BC | D | BD | C | AB | C | C | B | AD |
三、填空题
16、 KHCO3 ; 是
17、 (1) 3Na2S + As2S5 = 2Na3AsS4
(2) Na2S + SnS2 = Na2SnS3
(3) Na2S2 + SnS = Na2SnS3
18、(1)N2 O2 (2)偏低 (3)溴水 或 高锰酸钾
(4)22.4VaC/(22.4VaC+Vb) (5) c e g 或 b e g
四、计算题
19、 Cl2 — Na2SO3 — 2H+
10L *0.012moL/L = VNa2SO3*0.1moL/L VNa2SO3 = 1.2L
nH+ = 2*10L*0.012mol/L + 10L*0.001moL/L = 0.25moL
H+ — OH-
mNaOH = 0.25moL*40g/moL = 10g
20、 Fe — H2SO4 — H2 Fe — Cu △m=8g
mFe = 1.68L/(22.4L/moL) *56g/moL = 4.2g 1moL/nCu = 8g / (4.2g – 3.96g)
nH2SO4 = 1.68L/(22.4L/moL) = 0.075moL nCu = 0.03moL
Cu — 2H2SO4
nH2SO4总 = 0.075moL + 2*0.03moL = 0.135moL
cH2SO4 =[ 0.0135moL*(1.00L/0.05L)]/0.15L = 18moL/L