高一化学第六章第一节氧族元素练习
1、据下列四个反应:(1)H2S+I2====2H++2I-+S↓;(2)H2SO3+2H2S====3S↓+3H2O;
(3)2I-+Br2====I2+2Br-;(4)H2SO3+I2+H2O====4H++2I-+SO![]() ;
;
确定Br-、I-、H2S、H2SO3的还原性由强到弱的顺序是( )
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S
C.H2S>I->Br->H2SO3 D.I->Br->H2S>H2SO3
解析:本题旨在考查氧化还原反应由强到弱的规律,强化学生对于氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性的认识。因此,找出反应前后氧化剂和氧化产物,还原剂和还原产物,即可解决问题。
答案:A
2、根据元素周期律判断下列结论正确的是
①微粒半径:S2->Cl>S>F ②稳定性:HF>HCl>H2S>H2Te
③还原性:S2->Cl->Br->I- ④氧化性Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SO3 ⑥非金属性F>Cl>S>Sе
A.②④⑥ B.①③④ C.① D.⑥
本题考查元素周期律的记忆,及应用。答案:A
3、若已发现116号元素R,则下列叙述中正确的是
①某钠盐的分子式为Na2R,②其最高价氧化物的水化物是强酸,③R是金属元素,④R是非金属元素,⑤最高价氧化物的分子式为RO3
A.①③⑤ B.②④ C.③⑤ D.②③⑤
考查元素周期律的理解及元素周期律与元素周期表的关系;答案:A
4、有硫化钠、硫酸钠、亚硫酸钠的固体混合物,经测定含硫25.6%,则此混合物中氧的质量分数是
A.36.8% B.37.6% C.51.2% D.无法计算
本题考查观察、分析推理能力,从三种物质的分子组成发现其硫元素与钠元素的关系,
从而转换成求钠的质量分数。培养解题技巧。答案:B
5下列各组中互为同位素的是( ),互为同素异形体的是( )
A.O2和O3 B.![]() H和
H和![]() H C.H2O和H2O2 D.O2-和O
H C.H2O和H2O2 D.O2-和O
答案:B A
6:1995年,诺贝尔化学奖授于致力于研究臭氧层破坏问题的三位环境化学家,大气
中的臭氧层可滤除大量的紫外线,保护地球上的生物。氟利昂(氟氯烃的商品名称)上
升大气中,可在紫外光作用下分解产生氯原子,氯原子会对臭氧层产生长久的破坏
作用。有关反应如下:
|
![]()
![]()
![]() O3 O2+O Cl+O3 ClO+O2 ClO+O Cl+O2 总反应式:2O3====3O2
O3 O2+O Cl+O3 ClO+O2 ClO+O Cl+O2 总反应式:2O3====3O2
请判断,在上述臭氧变成氧气的反应过程中,氯原子是( )
A.反应物 B.生成物 C.中间产物 D.催化剂
(根据氯原子的行为特征可判断为催化剂,答案当为D)
7; 地球外层空间存在着少量的臭氧和氧原子,该臭氧层的存在能吸收和阻挡太阳光
中有害的强烈的紫外线辐射,然而人为的大气污染物会破坏臭氧层,如超音速飞机排
放物中氮的氧化物(NO和NO2),它们和O3及O发生如下反应:O3+NO====NO2+O2,
O+NO2====NO+O2,这两个反应反复循环,总反应为 ;由此可见氮氧化物在破
坏臭氧层的过程中起了 作用。
答案:O3+O====2O2 催化
8; 在下列四种溶液中,分别加入少量固体MnO2,能产生气
体的是( )
A.3% H2O2溶液 B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 KClO3溶液 D.1 mol·L-1 盐酸
解析;NaOH溶液与MnO2在任何条件下都不反应,C选项从表面看很似实验室制O2的方
法,但实验室制O2是用固体KClO3和MnO2固体在加热条件下制得,MnO2与浓盐酸在加
热条件下反应生成Cl2,D项中1 mol·L-1 HCl为稀盐酸,且缺少加热条件,故不可能
有Cl2产生,答案为A。此题应提醒学生注意反应条件。
9, 据报道,近期我国研制出![]() ,在这方面居世界前列,下列有关
,在这方面居世界前列,下列有关![]() 叙述正确的
叙述正确的
是(B)
A.与氧互为同位素 B.与氧气具有相同的化学性质
C.与氧气互为同素异形体 D.与同质量的氧气具有相同的体积
10.一瓶气体经化验只含一种元素,则该气体是(D)
A.一种单质 B.一种化合物
C.化合物与单质的混合物 D.既可能是一种单质,也可能是几种单质的混合物
11、下列关于臭氧性质的叙述中不正确的是(C)
A.臭氧比氧气的氧化性更强,常温下能将Ag、Hg等较不活泼的金属氧化
B.臭氧可以杀死许多细菌,是一种良好的消毒剂
C.臭氧和活性炭一样,能够吸附有机色素,是一种很好的脱色剂
D.臭氧和氧气在一定条件下可以相互转化
12,单质硫和强碱(如NaOH)溶液加热至沸,反应后,硫转化为S2-和SO![]() ,则反应的S
,则反应的S
和生成的S2-和SO![]() 的物质的量之比为( )
的物质的量之比为( )
A.2∶1∶1 B.3∶2∶1 C.3∶1∶2 D.4∶1∶3
解析:据题可知硫和强碱溶液在加热条件下,发生了氧化还原反应,利用题中提供的
信息可以写出发生反应的化学方程式:3S+6NaOH====2Na2S+Na2SO3+3H2O,由方程式
可知参加反应的S和生成的S2-、SO![]() 的物质的量之比为3∶2∶1。答案:B
的物质的量之比为3∶2∶1。答案:B
13 用有关符号填写:
氧、硫、硒、碲中,原子半径最小的是 ,单质氧化性最强的是 ,半径最大的阴离子是 ,还原性最弱的阴离子是 ,气态氢化物热稳定性最强的是 ,最高价氧化物的水化物酸性最弱的是 。
14, 在KI和H2SO4的混合液中加入H2O2水溶液,迅速反应产生大量气体,反应过程可表示
如下:
![]() ①H2O2+KI+H2SO4 K2SO4+H2O+I2
①H2O2+KI+H2SO4 K2SO4+H2O+I2
![]() ②H2O2+I2
HIO
②H2O2+I2
HIO
![]() ③H2O2+HIO I2+O2↑+H2O(以上反应式均未配平)
③H2O2+HIO I2+O2↑+H2O(以上反应式均未配平)
(1)H2O2在反应①中的作用是( )
A.还原剂 B.氧化剂
C.既不是氧化剂也不是还原剂 D.既是氧化剂又是还原剂
(2)有人认为:上述反应②③可说明I2是H2O2分解的催化剂,你认为 (填“对”或
“不对”),其理由是 。
答案:(1)B (2)对 I2在反应前后的质量和化学性质未改变
15, 过氧化氢(H2O2)俗名双氧水,医疗上可作外科消毒剂。仔细分析下列实验现象填空;
(1)向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水的
___________________性。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出
性。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应
的化学方程式为: 。
答案(1)氧化 (2)还原
(3)PbS+4H2O2====PbSO4+4H2O
16、在标准状况下,750 mL含O3的O2,其中的O3若完全分解,其体积变为780 mL
(标准状况),若将该含有O3的O2 1 L,通入适量的KI溶液中发生如下反应
2KI+O3+H2O====2KOH+I2+O2↑, 求析出I2的质量是多少克?
解析:此题在巩固和认识O3性质的基础上以训练学生的解题方法和能力。
首先根据2O3====3O2反应,采用差量法(ΔV)求得气体中O3的体积分数,然后
据2KI+O3+H2O====2KOH+I2+O2↑反应,采用关系式法(这里为O3~I2)求得m(I2)。
答案:0.91 g
17, 过氧化氢易分解,若在其水溶液中加入少量MnO2,可大大促进它的分解,因此可
用于实验室里制取O2。原理为不稳定2H2O2![]() 2H2O+O2↑,请设计反应装置。
2H2O+O2↑,请设计反应装置。
解析;根据反应物及催化剂的状态、反应条件选择反应容器,
根椐反应目的选择其他的辅助装置,因此本实验是固液不加
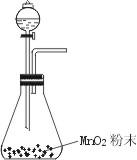 型的气体制备实验选用锥形瓶作反应容器如右图所示:
型的气体制备实验选用锥形瓶作反应容器如右图所示: