高一化学第七章总复习
一、碳族元素
思考:(1)为什么碳、硅主要形成共价化合物?
(2)“锡的+4价化合物稳定,铅的+2价化合物稳定”。由此推断SnCl2和PbO2的氧化性或还原性的强弱及变化产物。
(3)C60与金刚石的关系是什么?
二、硅
硅的化学性质
(1)在常温下化学性质很稳定,常温下发生的反应:
Si+2F2====SiF4
Si+4HF====SiF4↑+2H2↑
Si+2NaOH+H2O====Na2SiO3+2H2↑
|
Si+O2=====SiO2
|
SiO2+2C======Si+2CO↑
思考:(1)该反应中,氧化剂是 ,还原剂是 。碳置换硅跟“碳的非金属性比硅强”是否矛盾?
(2)列举几例同一主族元素单质间的置换反应。
三、二氧化硅
化学性质
(1)酸性氧化物的性质
|
SiO2+CaO======
SiO2+NaOH→
|
![]() SiO2+C
SiO2+C
(3)特性
SiO2+4HF====SiF4↑+2H2O
氢氟酸用于雕刻玻璃,就是基于此反应。
4.用途
(1)SiO2是制造光导纤维的主要原料。
(2)石英制作石英玻璃、石英电子表、石英钟等。
(3)水晶常用来制造电子工业的重要部件、光学仪器、工艺品等。
(4)石英砂常用作制玻璃和建筑材料。
思考:(1)为什么实验室不用带玻璃塞的试剂瓶盛放NaOH溶液?应用什么样的塞子?实验室能否用玻璃瓶保存氢氟酸?
(2)SiO2不溶于水,由SiO2如何来制取H2SiO3?
四、硅酸、硅酸盐
1.硅酸
|
![]() H2SiO3
H2SiO3
H2SiO3+NaOH→
2.硅酸钠
Na2SiO3固体俗称泡花碱,水溶液俗称水玻璃,是无色粘稠的液体,常作粘合剂、防腐剂、耐火材料。
Na2SiO3+HCl→
Na2SiO3+CO2+H2O→
3.硅酸盐
硅酸及其缩水结合而成的各种酸所对应的盐统称硅酸盐。
硅酸盐是构成地壳岩石的主要成分,种类很多,结构复杂,常用氧化物的形式来表示组成。
表示顺序为:活泼金属氧化物·较活泼金属氧化物·二氧化硅·水。
把下列硅酸盐改写成氧化物的形式:
硅酸钠Na2SiO3
镁橄榄石Mg2SiO4
钙沸石Ca(Al2Si3O10)·3H2O
正长石KAlSi3O8
思考:如何证实硅酸的酸性比碳酸弱?
五、材料概述
[例1]最近科学家研究得到一种新的分子,它具有空心的类似足球状结构,分子式为C60,下列说法正确的是
A.C60是一种新型的化合物 B.C60和石墨都是碳的同素异形体
C.C60中含离子键 D.C60的相对分子质量为720
[例2]实验室里保存下列试剂,其保存的方法和理由,描述都正确的是
| 编号 | 试剂 | 保存方法 | 理 由 |
| A | 固体氢氧化钠 | 存放在带橡皮塞的广口瓶中 | 防止与空气接触被氧化和与水蒸气、二氧化碳接触而变质 |
| B | 碳酸钠晶体 | 存放在干燥密封的广口瓶中 | 防止风化而碎裂成粉末 |
| C | 液溴 | 存放在带橡皮塞的细口瓶中,并用水封 | 防止挥发 |
| D | 过氧化钠粉末 | 存放在带玻璃塞的试剂瓶中 | 防止吸收水分而变质 |
[例3]生石灰中往往含有杂质CaCO3和SiO2,要检验是否存在这两种杂质,最好选用
A.水 B.盐酸 C.硫酸 D.烧碱溶液
[例4]有一无色气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下处理(假定每次处理均反应完全):
(1)通过碱石灰时,气体体积变小;
(2)通过赤热的氧化铜时,固体变为红色;
(3)通过白色硫酸铜粉末时,粉末变为蓝色;
(4)通过澄清石灰水时,溶液变浑浊。
由此可以确定原无色气体中:一定含有 ,可能含有 。
[练习1]熔融烧碱应选用的器皿是
A.石英坩埚 B.普通玻璃坩埚 C.生铁坩锅 D.陶瓷坩埚
[练习2]下列说法中,正确的是
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃溶液可以得到硅酸
C.在高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
[练习3]已知A是一种不溶于水的酸性氧化物。根据图转化关系,回答:
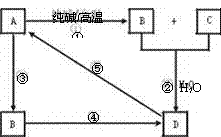 |
(1)A是 ,B是 , D是 。
(2)写出①→⑤各步反应的化学方程式,如是离子反应请改写成离子方程式。
①
②
③
④
⑤
[练习4]普通玻璃中Na2SiO3∶CaSiO3∶SiO2= 1∶1∶4 (物质的量之比)
(1)若以aNa2O·bCaO·mSiO2表示此玻璃的组成, 则a∶b∶m= 。
(2)若要制备1000 kg上述玻璃,需要原料各多少千克?共可产生标准状况下的CO2气体多少升?
答案:(1)1∶1∶6 (2)221.8 kg 209.2 kg 753.1 kg 9.37×104 L