高一年级化学第一学期期中检测
高 一 年 级 化 学 试 题
满分:120分 限时:90分钟 命题人:张发雄 检测时间:2003.11.7
可能用到的相对原子质量:H:1 C:12 N:14 F:19 O:16 S:32 Cl:35.5 Br:80
Na:23 K:39 Cu:64
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.下列反应一定属于氧化还原反应的是 ( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
2.下列变化需要加还原剂才能实现的是 ( )
A.Fe3+→Fe2+ B.Cl-→Cl2 C.H2S→SO2 D.S2-→H2S
3.NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.1mol钠作还原剂可提供的电子数为NA
B.1mol O2所含的原子数为NA
C.1mol H2O中所含的电子数为8NA
D.2mol H2O所含的氧原子数与1mol CO2所含的氧原子数均为NA
4.在氧化还原反应:3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子的物质的量之比为 ( )
A.1∶2 B.2∶1 C.1∶1 D.3∶2
5.某化合物易溶于水,但其水溶液不导电,则该物质是 ( )
A.强电解质 B.弱电解质 C.非电解质 D.不能确定其类型
6.下列叙述中错误的是 ( )
A.离子化合物一般是强电解质 B.共价化合物都是非电解质
C.强酸、强碱一定是强电解质 D.强电解质的水溶液一定能导电
7.下列反应中,能用离子方程式:H++OH-=H2O表示的是 ( )
A.稀硫酸与氢氧化钡溶液反应 B.硝酸溶液与烧碱溶液反应
C.醋酸与KOH溶液反应 D.盐酸与Fe(OH)3反应
8.下列各组离子在溶液中能大量共存的是 ( )
A.Cu2+、K+、OH-、NO3- B.H+、Na+、CO32-、SO42-
C.Ba2+、Cl-、H+、SO42- D.Na+、Ba2+、NO3-、OH-
9.一定量的氧气含有1mole-,这些氧气的质量是 ( )
A.2g B.4g C.16g D.32g
10.如果2g甲烷中含n个分子,那么35.5g氯气中所含的分子数是 ( )
A.2n B.3n C.4n D.5n
11.下列说法错误的是 ( )
A.得电子的反应物是氧化剂
B.在化学反应中某元素化合价升高,即被氧化
C.氧化剂被还原后,所得到的生成物称氧化产物
D.还原剂在被氧化过程中,元素的化合价升高
12.由锌、镁、铝、铁四种金属中的两种组成的混合物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混合物中一定含有的金属是 ( )
A.锌 B.铁 C.铝 D.镁
13.某溶液中含有K+、Mg2+、SO42-、NO3-四种离子,已知其中Mg2+、K+、NO3-三种离子的个数比为4∶5∶3,则SO42-与NO3-离子的个数比为 ( )
A.1∶1 B.4∶3 C.5∶3 D.2∶1
14.下图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2), A、B是两种可燃气体, C是A和B的混合气体,由图象可知C中n(A) ∶ n(B)为 ( )
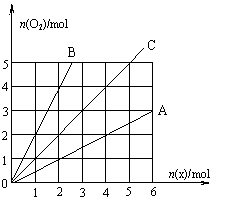
A.2∶1 B.1∶2 C.1∶1 D.任意比
二、选择题(本题包括5小题,每小题4分,共20分。每小题有1个或2个选项符合题意)
15.某元素一个原子的质量为a g,又知1个12C原子的质量为b g,NA代表阿伏加德罗常数,则下列各式中能表示该原子的相对原子质量数值的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
16.已知PbSO4难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4。当向(CH3COO)2Pb溶液中通入H2S时有黑色PbS沉淀生成,下列表示这个反应的离子方程式正确的是( )
A.(CH3COO)2Pb+H2S=PbS↓+2CH3COOH
B.Pb2++H2S=PbS↓+2H+
C.Pb2++2CH3COO-+H2S=PbS↓+2CH3COOH
D.Pb2++2CH3COO-+2H++S2-=PbS↓+2CH3COOH
17.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是 ( )
A.2 B.3 C.4 D.5
18.已知X2、Y2、Z2、W2四种物质的氧化能力依次减弱的顺序为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ( )
A.2W-+Z2=2Z-+W2 B.2X-+Z2=2Z-+X2
C.2Y-+W2=2W-+Y2 D.2Z-+X2=2X-+Z2
19.相同条件下的两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,则两容器内的气体一定具有相同的 ( )
A.原子数 B.电子总数
C.分子总数 D.质量
三、(本题包括2小题,共15分)
20.(7分)如图所示,把试管放入盛有25℃时的饱和澄清石灰水中,试管中先放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
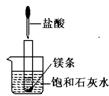 (1)实验中观察到的现象是
。
(1)实验中观察到的现象是
。
(2)产生上述现象的原因是
。
(3)写出有关反应的离子方程式:
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大
于”或“小于”或“等于”)镁片和盐酸的总能量。
21.(8分)现有失去标签的氯化镁,碳酸钠,硫酸,氢氧化钡四种无色溶液,为了确定四种溶液各是什么,将它们随意编号为A,B,C,D后,按下表进行实验,产生的现象如下所示(氯化镁和碳酸钠反应生成的MgCO3是沉淀物质):
| 反应编号 | 反应物质 | 有关现象 |
| ① | A+B | 有沉淀生成 |
| ② | B+C | 有气体放出 |
| ③ | C+D | 有沉淀生成 |
| ④ | B+D | 无明显现象 |
| ⑤ | A+D | 有沉淀生成 |
根据实验现象按要求回答:
(1)写出各物质化学式:A B C D
(2)写出实验中反应①、②的有关的离子方程式
①
②
四、(本题包括2小题,共14分)
22.(6分) 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
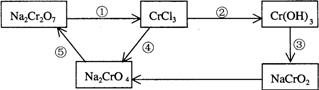
(1)元素Cr的常见化合价是 和 。
(2)在上述有编号①②③④⑤的步骤中,需用还原剂的是 _,需用氧化剂的是_______(填编号)。
(3)Cr(OH)3是难溶于水的碱,但能溶于强酸和强碱,请写出Cr(OH)3分别与H2SO4、NaOH反应的离子方程式: 、
23.(8分) 用双线桥标出下列反应中电子转移方向和数目,并指出氧化产物和氧化剂
(1)KClO3+6HCl == KCl+3Cl2↑+3H2O 氧化产物 氧化剂
(2)3Cl2+8NH3 == 6NH4Cl+N2 氧化产物 氧化剂
五、(本题包括2小题,共16分)
24.(8分)写出下列反应的离子方程式:
(1)醋酸与氨水反应:
(2)硫酸镁溶液与Ba(OH)2溶液反应
(3)向FeBr2溶液中通入少量Cl2
(4)向NaHSO4溶液中滴加Ba(OH)2至溶液呈中性
25.(8分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含有K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
甲厂的废水中明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。
乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属 (填写金属元素符号)。
另一种设想是将甲厂乙两厂的废水按适当的比例混合,使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
六、(本题包括2小题,共13分)
26.(5分) 由NaCl、Na2SO4、KCl组成的混合溶液中,Cl-离子质量为71g,K+离子质量为39g,SO42-离子质量为96g,求溶液中Na+离子的质量。
27.(8分) 在干燥烧瓶中用向下排空气法收集氨气,测得瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中(氨气全部溶于水),烧瓶内液面上升的体积占烧瓶总体积为多少?
期中检测化学试题参考答案及评分标准
一. (每小题3分,共42分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | C | A | A | A | C | B | B | D | A | C | C | C | C | A |
二. (每小题4分,共20分。有错选则计0分,漏选计2分)
| 题号 | 15 | 16 | 17 | 18 | 19 |
| 答案 | BC | A | D | BC | AC |
三.(本题包括2小题,共15分)
20.(7分)
(1) 试管中有气泡冒出;烧杯中溶液变混浊。(2分)
(2) 镁条与盐酸反应产生氢气,同时放出热量。放出的热量使饱和石灰水温度升高,降低了氢氧化钙的溶解度,结果有氢氧化钙固体析出。(2分)
(3) Mg +2H+=Mg2+ +H2↑ (2分)
(4) 小于 (1分)
21.(8分)
(1) A:Ba(OH)2 B:H2SO4 C:Na2SO4 D:MgCl2 (每个1分,共4分)
(2) ①2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O (2分)
②2H++CO32-=CO2↑+H2O (2分)
四.(本题包括2小题,共14分)
22.(6分)
(1)+3 ; +6 (1分)
(2)① ; ④ (1分)
(3) Cr(OH)3+3H+=Cr3++3H2O; Cr(OH)3+OH-=CrO2-+2H2O (每个2分,共4分)
23.(8分)(每小题中电子转移方向和数目各1分,氧化产物和氧化剂各1分
![]() (1)KClO3+6HCl=KCl+3Cl2↑+3H2O 氧化产物:Cl2 氧化剂:KClO3
(1)KClO3+6HCl=KCl+3Cl2↑+3H2O 氧化产物:Cl2 氧化剂:KClO3
![]() (2)3Cl2+8NH3=6NH4Cl+N2
氧化产物:N2 氧化剂:Cl2
(2)3Cl2+8NH3=6NH4Cl+N2
氧化产物:N2 氧化剂:Cl2
五.(本题包括2小题,共16分)
24.(8分)(每个方程式2分)
(1) CH3COOH+NH3·H2O = CH3COO-+NH4++H2O
(2) Mg2++SO42-+Ba2++2OH-=BaSO4↓+Mg(OH)2↓
(3) 2Fe2++Cl2=2Fe3++2Cl-
(4) 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
25.(8分)(除倒数第二空为2分外,其余空均为1分)
OH-、K+、Cl-;Fe;Ag;Ag+、Fe3+、Cl-、OH-;KNO3
六.(本题包括2小题,共13分)
26.(5分) 69g
27.(8分) ![]() 或83.3%
或83.3%