氮 族 元 素
一、选择题(本题共20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1. 将NO3-+Zn+OH-+H2O→NH3+Zn(OH)42-配平后,离子方程式中H2O的化学计量数是 ( )
A. 2 B. 4 C. 6 D. 8(MCE01)
2. 浓硝酸与下列物质反应,其中硝酸既表现酸性又表现氧化性的是 ( )
A. Cu2O B. CuO C. Fe2O3 D. FeCO3
3. 安全火柴在磨擦起火的过程中,可能发生化学反应的两种物质是 ( )
A. 氯酸钾和二氧化锰 B. 氯酸钾和白磷
C. 氯酸钾和红磷 D. 二氧化锰和三氧化二锑
4.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域的研究有重大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖;关于NO的下列叙述不正确的是 ( )
A. NO可以是某些含低价N物质氧化的产物(MCE99)
B. NO不是亚硝酸酐
C. NO可以是某些含高价N物质还原的产物
D. NO是红棕色气体
5. 下列各组物质中,每种物质对人体都有毒害作用的是 ( )
A. 白磷、红磷 B. 二氧化碳、二氧化硫 C. 氯气、氮气 D. 一氧化碳、一氧化氮
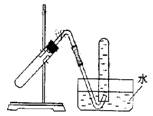 6.右图装置可用于
(
)
6.右图装置可用于
(
)
A. 加热NaHCO3制CO2(MCE99)
B. 用Cu与稀HNO3反应制NO
C. 用NH4Cl与浓NaOH溶液反应制NH3
D. 用NaCl与浓H2SO4反应制HCl
7. 将H2和N2以3∶1体积比通入合成塔中,一定条件下达平衡后混合气含NH3 12%(体积分数),则N2的体积分数为 ( )
A. 25% B. 22% C. 33.3% D. 18%
8.关于氮族元素(用R代表)的下列叙述正确的是 ( )
A.最高化合价是5 B.氢化物的通式为RH5(MCE01春)
C.非金属性由上到下递增 D.其含氧酸均为一元强酸
9. 工业上使50%的硝酸浓缩为浓硝酸应采取的措施是 ( )
①蒸去水 ②加浓硫酸蒸馏 ③加硝酸镁蒸馏 ④加无水氯化钙蒸馏 ⑤加碱石灰 ⑥加五氧化二磷蒸馏
A. ①②③ B. ②③④ C. ①⑤ D. ②③⑥
10. 下列实验现象描述错误的是 ( )
A. 磷在氧气中燃烧产生大量白雾 B. 钠在空气中剧烈燃烧,生成淡黄色固体
C. 氢气在氯气中燃烧发出苍白色火焰 D. 硫在空气中点燃产生微弱的淡蓝色火焰
11. 硫在加热时能被N2O氧化成SO2,现用3.2 g硫粉和224 mL(标准状况)N2O在加热下充分反应,反应结束后气体混合物在标准状况下的体积为 ( )
A. 112 mL B. 224 mL C. 336 mL D. 448 mL
12. 把少量的NO2气体通入过量的小苏打溶液中, 再使逸出的气体通过装有过氧化钠颗粒的干燥管,最后收集到的气体是 ( )
A. O2 B. NO2 C. NO2和O2 D. CO2和NO
13. 从某些方面看,NH3和H2O相似,那么下面结论中不正确的是 ( )
A. ![]() 和H3O+相当
B. NH2-和OH-相当
和H3O+相当
B. NH2-和OH-相当
C. NH2-和O2-相当 D. N3-和O2-相当
14. 化工厂常用浓氨水检验管道是否漏氯气,化学方程式为:3Cl2+8NH3=6NH4Cl+N2,当生成160.5 g NH4Cl时,被氧化的氨水(含NH3 30%,密度为0.892 g/cm3)的体积为
( )
A. 508.2 mL B. 63.5 mL C. 254.1 mL D. 127.0 mL
15. 工业上以空气、煤等原料制取硝酸铵,其生产过程有6个阶段:①合成氨 ②空气液化分离 ③氨氧化 ④制取水煤气 ⑤生成硝酸 ⑥生成硝酸铵。制取硝酸铵最合理的生产流程是 ( )
 16.
16.![]() -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。![]() 表示的碳原子 ( )
表示的碳原子 ( )
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子(MCE00)
D.质量数为13,原子序数为6,核内有7个中子
17. 氨氧化法制硝酸,为了使NO2充分被水吸收,下列措施中最有效的是 ( )
A. 增大压强 B. 加水 C. 通入空气 D. 分离出硝酸
18. 砷的含氧酸的分子式不可能的是 ( )
A. H3AsO3 B. H3AsO4 C. H2AsO4 D. HAsO3
19. 在两密闭容器中分别盛有31 g白磷和1 mol氧气,控制条件使其发生如下反应:
容器甲:P4+5O2=P4O10
容器乙:P4+3O2=P4O6
经充分反应后,两容器中分别所得的P4O10和P4O6的物质的量之比为 ( )
A. 5∶4 B. 4∶5 C. 4∶3 D. 3∶1
20. 下列各组物质混合时,若某一物质过量,都能发生两步反应,在由于过量而发生的两步反应中,反应物的物质的量之比都为1∶1的是 ( )
A. 二氧化碳通入氨水至过量 B. 锌粉和硫酸铁溶液
C. 稀氨水和稀硝酸银溶液 D. 氢氧化钾溶液和硫酸铝溶液
二、填空题(本题包括7小题,共30分)
21. (4分)浓硝酸使金属铝产生钝态是因为浓硝酸具有_____性。 浓硝酸跟纤维素反应生成硝酸纤维,这一反应属于_____反应。浓硝酸常常呈黄色是因为混有______杂质。稀硝酸和铜反应制NO时,若浓度稍大则有NO2产生,此时要制取较纯的NO, 在不改变硝酸浓度的前提下,可采用的方法是_________________________________________________。
22. (4分)一种蜡状固体在空气中完全燃烧生成白色粉末X,将X 加入冷水中生成含氧酸Y,将X加入热水中生成含氧酸Z。从以上实验现象可判断此蜡状固体是__________,X是________,Y是_________,Z是__________。
23. (3分)某金属M的硝酸盐受热时按下式分解:2MNO3![]() 2M+2NO2↑+O2↑,加热3.40 g MNO3,生成NO2和O2共672 mL(标准状况时的体积)。由此可以计算出M的原子量为________。
2M+2NO2↑+O2↑,加热3.40 g MNO3,生成NO2和O2共672 mL(标准状况时的体积)。由此可以计算出M的原子量为________。
24. (3分)工业上制硝酸,从吸收塔中放出的尾气能污染大气的主要物质是_______和_______,为消除污染,常用________吸收尾气。
25. (6分)使一定量磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,
第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜。第一支玻璃管中由于发生如下的反应:2PH3+3Cu![]() Cu3P2(固)+3H2,玻璃管的质量增加4.96 g; 第二支玻璃管质量在发生反应后减少了5.76 g。则原混合气体中,磷化氢和氢气的体积比是_____________;在标准状况下,原混合气体的密度是_________________。
Cu3P2(固)+3H2,玻璃管的质量增加4.96 g; 第二支玻璃管质量在发生反应后减少了5.76 g。则原混合气体中,磷化氢和氢气的体积比是_____________;在标准状况下,原混合气体的密度是_________________。
26. (5分)有一种白色固体A和一种黄色固体B做如下实验:
⑴ A与等物质的量的一元强酸和一元强碱都能完全作用,依次生成有毒气体C 和极易溶于水的气体D;
⑵ B在空气中燃烧生成气体E,E与C反应又生成B;
⑶ 将D通入滴有石蕊的水中,溶液呈蓝色,再通入E,过量时溶液由蓝变红;
⑷ 将E与空气混合后,通入装有催化剂的灼热的玻璃管,气体出口处有白雾生成。
则A、B、C、D、E、分别是A___________,B__________,C__________,D__________,E_________。
27. (5分)Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O;
⑴ 写出反应的化学方程式并配平:
_____________________________________________________________________;
⑵ 上述反应中,当生成1.8 mol Fe3+时,放出NO的体积(标准状况下)是_______ L,消耗的HNO3是________ mol;
⑶ 上述反应中,当有21 mol电子发生转移时,生成H3PO4是________ mol,被还原的HNO3是_________ g。
三、计算题(10分)
28.(10分)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1) 写出反应的化学方程式并标出电子转移的方向和数目。(MCE00)
(2) 若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
答 案
1.C 2.A 3.C 4.D 5.D 6.B 7.B 8.A 9.D 10.A 11.C 12.C 13.D 14.B 15.D 16.D 17.C 18.C 19.B 20.A
21. (每空1分)氧化; 酯化; 二氧化氮; 用排水法收集NO
22. (每空1分)白磷; 五氧化二磷; 偏磷酸; 磷酸
23. (3分)108
24. (3分)NO; NO2; 碱液
25. (每空3分)4∶3; 0.91 g/L
26. (每空1分)NH4HS; S; H2S; NH3; SO2
27. (每空1分)⑴3Fe3P+41HNO3=9Fe(N03)3+14NO↑+3H3PO4+16H2O ⑵62.72; 8.2 ⑶1.5; 441
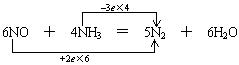 28. (10分)
28. (10分)
(1) (方程式2分,电子转移2分)
(2) 6 mol NO还原得到3 mol N2,4 mol NH3氧化得到2 mol N2,两者相差1 mol N2。现相差1.4g,![]() =0.05 mol,相当于0.3 mol NO和0.2 mol NH3反应。
(3分)
=0.05 mol,相当于0.3 mol NO和0.2 mol NH3反应。
(3分)
依题意,NO和NH3的总物质的量为1 mol,其中必有一种为过量,所以有两种情况:
0.3 mol NO和0.7 mol NH3
0.8 mol NO和0.2 mol NH3(对一组2分,两组都对3分) (3分)