高一化学练习—元素周期表
学校 姓名 座号 平分
1.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是( )
A HF B H3O+ C NaH D H2O2
2.(97年高考题)下列各组微粒中,核外电子总数相等的是( )
(A) K+、Na+ (B)CO2、NO2 (C)CO 、CO2 (D)N2、CO
3.(03年上海卷)以NA表示阿佛加德罗常数,下列说法中正确的是( )
A 53g碳酸钠中含NA个CO32- B 0.1molOH-含NA个电子
C 1.8g重水(D2O)中含NA个中子 D 标准状况下11.2L臭氧中含NA个氧原子
4.镭是元素周期表中第7周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是( )
(A)在化合物中呈+2价 (B)单质能与水反应放出氢气
(C)它的氢氧化物为弱碱 (D)镭元素的金属性比钡弱
5.下列关于元素周期律和元素周期表的论述中正确的是( )
(A)同一主族的元素,从上到下单质熔点逐渐升高
(B)元素周期表是元素周期律的具体表现形式
(C)同一周期从左到右,元素原子半径逐渐增大
(D)周期表中Ⅳ~Ⅶ主族元素可表现正化合价
6.在短周期元素中,属于非金属元素的有( )
(A)9种 (B)10种 (C)12种 (D)13种
7.有短周期的三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同。又知三元素最外层电子数之和为14,而质子数之和为28。则三种元素有可能是( )
(A) C、N、P ( B) N、O、S (C) N、P、F (D)Be、O、S
8.同位素是( )
(A)有相似化学性质的不同核素 (B)同一种元素的不同核素
(C)最外电子层上有不同电子数的原子 (D)有相同质量数的不同元素的原子
9.迄今为止合成的最重的元素是112号元素,它是用 ![]() 高能原子轰击
高能原子轰击
![]() 的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是( )
的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是( )
(A)112号元素是金属元素
(B)112号元素位于第七周期第四主族
(C)科学家合成的112号元素的原子的中子数为166
(D)112号元素为放射性元素
10.据测,哈雷彗星上碳的两种同位素12C和13C的原子个数比为65︰1,而地球上12C和13C的原子个数比为89︰1。地球上碳元素的原子量是12.011,那么哈雷彗星上碳元素的原子量应是( )(A) 12.000 (B)12.009 (C) 12.015 (D) 12.980
11.(99全国)原计划实现全球卫星通讯需发射77颗卫星,这与铱( ![]() )元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是
)元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是
![]() ,则其核内的中子数是( ) (A)77 (B)114 (C)191 (D)268
,则其核内的中子数是( ) (A)77 (B)114 (C)191 (D)268
12.(91全国,2000春北京)某元素一种同位素的原子的质子数为m,中子数为n,则下述论断正确的是( )
(A)不能由此确定该元素的原子量
(B)这种元素的原子量为m+n
(C)若碳原子质量为W g,此原子的质量为(m+n)Wg
(D)核内中子的总质量小于质子的总质量
13.(93全国)1992年,我国取得重大科技成果之一是发现了三种元素的新的同位素,其中一种是 ![]() ,它的中子数是( )
,它的中子数是( )
(A)80 (B)128 (C)208 (D)288
![]() 14.(95上海)
14.(95上海)
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
是(
)
,
是(
)
(A)氢的五种同位素 (B)五种氢元素
(C)氢的五种同素异形体 (D)氢元素的五种不同微粒
15.(95上海)硼有两种天然同位素
![]() ,
,
![]() ,硼元素的原子量为10.80,则对硼元素中
,硼元素的原子量为10.80,则对硼元素中 ![]() 质量百分含量的判断正确的是( )
质量百分含量的判断正确的是( )
(A)20% (B)略大于20% (C)略小于20% (D)80%
16.(97全国)X、Y、Z和R分别代表四种元素。如果 ![]() ,
,
![]() ,
,
![]() ,
,
![]() 四种离子的电子层结构相同(a,b,c,d为元素的原子序数),则下列关系正确的是( )
四种离子的电子层结构相同(a,b,c,d为元素的原子序数),则下列关系正确的是( )
(A)a-c=m-n (B)a-b=n-m
(C)c-d=m+n (D)b-d=n+m
17.(90全国)X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层次相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是( )
(A)X>Y>Z (B)Y>X>Z (C)Z>X>Y (D)Z>Y>X
18.(97全国)已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是( )
(A)铍的原子半径大于硼的原子半径(B)氯化铍分子中铍原子的最外层电子数是8
(C)氢氧化铍的碱性比氢氧化钙的弱(D)单质铍跟冷水反应产生氢气
19.(94全国)若短周期中的两种元素可以形成原子个数比为2:3化合物,则这两种元素的原子序数之差不可能是( )
(A)1 (B)3 (C)5 (D)6
20.(96全国)X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
(A)X的原子序数比Y的小 (B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大 (D)X元素的最高正价比Y的小
21.(99全国)已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比为( )
(A)39:61 (B)61:39 (C)1:1 (D)39:11
22.(2000年全国)下列关于稀有气体的叙述不正确的是( )
(A)原子的最外电子层都有8个电子
(B)其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布
(C)化学性质非常不活泼
(D)原子半径比同周期ⅦA族元素原子的大
23.(98全国)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为( )
(A) ![]() (B)
(B)
![]() (C)
(C) ![]() (D)
(D) ![]()
24.(99上海)据报道,上海某医院正在研究用放射性同位素碘
![]() 治疗肿瘤。该同位素原子核内的中子数与核外电子数之差是( )
治疗肿瘤。该同位素原子核内的中子数与核外电子数之差是( )
(A)72 (B)19 (C)53 (D)125
25.国际纯粹化学和应用化学联合会决定,从1989年开始取消原长式周期表中的主、副族及族号,按由左至右顺序编为18列,碱金属(含氢元素)为第一列,稀有气体为第18列。按照这个规定,下列说法不正确的是( )
(A)第三列元素种类最多,第14列元素形成的化合物种类最多
(B)第七列元素的氧化物属于酸性氧化物
(C)第17列元素的单质具有强氧化性,都能把Fe氧化为Fe3+
(D)第11列元素单质不与稀硫酸反应
26.(2000年全国)甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
(A)x+2 (B)x+4 (C)x+8 (D)x+18
27.(2000春北京)已知元素砷(As)的原子序数为33,下列叙述正确的是( )
(A)砷元素的最高化合价为+3 (B)砷元素是第四周期的主族元素
(C)砷原子的第3电子层含有18个电子 (D)砷的氧化物的水溶液呈强碱性
28.(93上海)A、B、C、D四种短周期元素的原子序数依次增大。( )
A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子数之比为4:1。由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1:1,丙中为2:1。由D、C组成的化合物丁和戊都为固态,丁中D、C原子数之比为1:1,戊中为2:1。写出化学式:
甲 、乙 、丙 、丁 、戊 ;写出B元素的最高价氧化物跟丁发生反应的化学方程式 。
29.下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置。用化学符号回答下列各问题。
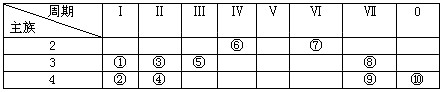
(1)10种元素中,化学性质最不活泼的是_______________。
(2)①、③、⑤三种元素最高价氧化物对应水化物中,碱性最强的是___________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是__________>__________>__________________。
(4)元素⑦的氢化物的化学式为__________;该氢化物常温下和元素②的单质反应的化学方程式为__________________;若该氢化物和元素⑧的单质反应,则化学方程式为_______
(5)①和⑨的最高价氧化物对应水化物的化学式为__________和____________。①和⑨两元素形成化合物的化学式为_____________;该化合物灼烧的焰色为__________色;该化合物的溶液与元素⑧的单质反应的化学方程式为_________________________________。
(6)①和⑤最高价氧化物对应水化物相互反应的化学方程式为____________;离子方程式为_____________________________。
(7)⑥与⑧形成化合物的化学式为_________________;单质⑨溶于该化合物所得溶液_____色。
(8)⑧和⑨两元素的核电荷数之差为__________________。
30.如果发现了原子序数为116的元素,对它的正确叙述是下列组合中的 ( )
① 位于第七周期;②是非金属元素;③最外电子层含有6个电子;
④没有放射性;⑤属于氧族元素;⑥属于卤素
A.①③⑤ B.①③⑥ C.②④⑥ D.②③⑤
31.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数 ( )
A.只有x+1 B.可能是x+8
C.可能是x+2 D.可能是x+1或x+11或x+25
32.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈
碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径
最小的元素,则它们的原子序数由小到大的顺序是 ( )
A. A、B、C、D、E B. E、C、D、B、A
C. B、A、D、C、E D. C、D、A、B、E
33.短周期元素 X 和 Y 可以形成 XY4 型化合物, 若 X 的原子序数为 m , Y 的原子序数为
n , 则 m 和n 的相互关系为 ( )
A.m – 13 = n B.n + 5 = m C.m + 8 = n D.n – 11 = m
34.无机化学命名委员会(国际组织)在1989年作出决定,把长式元素周期表原先的主、副族 及族号取消,由左到右改为18列,如碱金属族为第1列,稀有气体元素为第18列。按此规定 ,下列说法中错误的是 ( )
A.第16、17列都是非金属元素
B.第1列金属元素和第17列元素的单质熔、沸点变化趋势相反
C.只有第2列元素原子最外层有2个电子
D.在18列元素中,第3列元素种类最多
35.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:
HXO 4>H2YO4>H3ZO4,则下列各判断中正确的是 ( )
A.原子半径:X>Y>Z B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z D.原子序数:X>Y>Z
36.A、B、C是周期表中相邻的二二种元素,A和B同周期,B和C同主族,三种元素原子最外层电予数的和为14,核内质子数和为28,则A、B、C三种元素分别是( )
A.N P O B.Li Be Mg C.C N P D.O S F
37.如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的![]() ,则下列说法中不正确的是 ( )
,则下列说法中不正确的是 ( )
A.原子半径由大到小排列顺序Z>Y>X
![]()
![]()
![]()
![]() B.Y元素的两种同素异形体在常温下都是气体
B.Y元素的两种同素异形体在常温下都是气体
![]()
![]()
![]()
![]() C.最高价氧化物对应水化物的酸性W>Z
C.最高价氧化物对应水化物的酸性W>Z
D.阴离子半径由大到小排列顺序X>Y>Z>W
38.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示) (3)d溶于水的电离方程式
(4)c微粒是 ,f微粒是 (用化学式表示)