高一化学第二学期期未模拟试卷
一、选择题(每小题只有一个正确答案)
1.下列物质不属于“城市空气质量日报”报道的是( )
A. 二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
2.钋(![]() Po)原子核内的中子数与核外电子数之差是( )
Po)原子核内的中子数与核外电子数之差是( )
A.40 B.168 C.126 D.42
3.氮化硅陶瓷是一种新型无机非金属材料,它可用于制造陶瓷发电机,这是利用了这类材料的( )特性
A.耐高温、耐腐蚀特性 B.电学特性
C.光学特性 D.生物特性
4、①硝酸 ②水 ③碳 ④氢氟酸 ⑤氢氧化钾溶液中,能与二氧化硅起化学反应的是
A、①②④ B、②⑤ C、②③④ D、③④⑤
5.下列粒子的个数比不是1∶1的是( )
A.NaHCO3晶体中的阴离子和阳离子 B.Na2O2固体中的阴离子和阳离子
C.氘原子中的质子和中子 D.NH3分子中的质子和电子
6.将浓硫酸慢慢注入浓盐酸中,产生现象是( )
A.放出黄绿色气体 B.冒白雾,混合物温度升高
C.液体四溅 D.冒白烟,液体四溅
7、已知:①硫酸比次氯酸稳定 ②高氯酸的酸性比硫酸强 ③S2-比Cl-易被氧化 ④HCl比H2S稳定 ⑤铜与盐酸不反应,与浓硫酸能反应。上述可说明氯比硫非金属性强的是:( )
A.全部 B.②③④ C.①②④ D.除①以外
8.某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
A. H2XO3 B.HXO3 C.H3XO4 D.H2XO4
9.某氧化剂起氧化作用的是X2O72-,在溶液中0.2mol的该离子恰好能使0.6mol的SO2-3完全氧化,则X2O72-被还原后X的化合物价为:( )
A.+3价 B.-3价 C.+2价 D.+4价
10.一定条件下,有O2和O3组成混合气a L,当混合气中O3全部变成O2(即:2O3=3O2)后,气体体积变为1.2 aL(气体体积相同条件下测得)。则原混合气中含O3的体积分数为( )
A、80% B、60% C、40% D、20%
二、选择题(每小题有一个或两个正确答案)
11、熔融烧碱应选用( )
A、陶资坩埚 B、生铁坩埚 C、石英坩埚 D、氧化铝坩埚
12、将过量的CO2气体通入下列溶液中,最终不出现浑浊的是( )
A.澄清石灰水 B.CaCl2溶液 C.水玻璃 D. Na2CO3饱和溶液
13、将过量金属锌投入到含0.2molH2SO4的热浓硫酸中,下列判断正确的是( )
A.因发生“钝化”而不反应 B.产生的SO2为0.100mol
C.产生SO2少于0.100mol D.除SO2外还会有H2产生
14.过氧化氢与硫酸酸化的KMnO4溶液中进行反应生成K2SO4、MnSO4、H2O和O2。如果过氧化氢中的氧原子是示踪原子(![]() O),当反应完成后,含有示踪原子的物质是( )
O),当反应完成后,含有示踪原子的物质是( )
A.氧气 B.水 C.MnSO4 D.K2SO4
15、下列离子方程式中正确的是
A、亚硫酸溶液中滴入少量氢氧化钠溶液:H2SO3+OH-=HSO3-+H2O
B、二氧化硅与氢氧化钠的反应: OH—+SiO2=SiO32—+H2O
C、硫酸铵溶液与氢氧化钡溶液的反应:NH4++OH-=NH3↑+H2O
D、锌与稀硝酸的反应:Zn+2H+=Zn2++H2↑
16、下列说法不正确的是:
A、 二氧化硫能使紫色高锰酸钾溶液褪色,体现了二氧化硫的漂白性
B、 二氧化硫是硫及某些含硫化合物在空气中燃烧的产物
C、陶瓷、水泥、玻璃都属于硅酸盐产品 D、二氧化硅是一种坚硬难熔的物质
17.下列各组气体中,通常情况不能共存,且能用浓H2SO4 干燥的是( )
A、O2、N2、SO2 B、SO2、H2S、Cl2 C、H2S、CO2、HCl D、HI、O2、H2
18.氢化钠(NaH)是一种离子化合物,其中钠是+1价。NaH与水反应放出H2,下列叙述中正确的是( )
A.NaH在水中显酸性 B. NaH中氢离子的电子排布与氖相同
C. NaH 中氢离子半径比锂离子半径大 D. NaH中氢离子可被还原成H2
19.检验SO2中是否含CO2气体应采用的方法是( )
A通入Ca(OH)2溶液 B先通入饱和NaHCO3溶液,再入澄清石灰水
C先入KMnO4溶液再通入澄清石灰水 D通入品红溶液
20、.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,下列判断正确的是( )
A.元素金属性:B>A;元素非金属性:D>C
B.原子半径:A>B>C>D
C.离子半径:D(n+1)->Cn->B(n+1)+>An+
D.原子序数:b>a>c>d
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
班级: 学号: 姓名: _分数:
三、填空题(本题包括)
21、将2体积的SO2和1体积的Cl2(同温同压下)充分混合后,通入加有品红溶液的BaCl2溶液中,可观察到的现象 ,写出有关反应的离子方程式 。
22、(1)只用一种试剂鉴别NaNO3、BaCl2、Na2CO3三种溶液,这种试剂是 。
(2)KAlSi3Ox是正长石的化学式,其中x=______,若以氧化物的形式表示其组成应写成__________________________。
23、四种元素:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同周期,A、C处于同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层电子数是D原子最外层上电子数的4倍。试回答:
(1)这四种元素分别是:A: B: C: D:
(2)分别写出化合物AB2和D2B的电子式:
AB2 D2B
(3)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式。
24、“碳族元素的化合价主要有+4和+2,碳、硅、锗、锡的+4价的化合物是稳定的,而铅的+2价的化合物是稳定的。”这句话实际上指出了铅的+4价化合物是不稳定的,容易转变为+2价的化合物。这里所说的+4价的铅的化合物“不稳定”并不是指其热稳定性(即加热是否容易分解),而是指+4价的铅的化合物具有较强的 性,如果向PbO2中加入浓盐酸,会产生黄绿色气体,写出该化学反应的化学方程式 。
25、硫酸厂为保护环境、保证生产,须经常检查炉气中的SO2含量,方法是使炉气通过含淀粉的0.05mol/LI2溶液10ml。使溶液的蓝色恰好消失,此时剩余112ml气体(标况下),
⑴写出有关反应方程式 _ ____⑵炉气中的SO2含量(体积分数)是 __________.
四、实验题
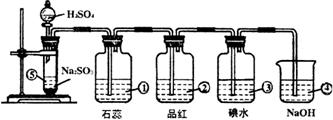 26、下图是实验室制SO2并验证SO2某些性质的装置图(设二氧化硫能够依次通过)。试回答:
26、下图是实验室制SO2并验证SO2某些性质的装置图(设二氧化硫能够依次通过)。试回答:
⑴⑤中发生的化学反应方程式为______________________________。
⑵①中的实验现象为__________,此实验证明SO2是__________气体。
⑶②中的品红溶液__________,证明SO2有__________。
⑷③中的现象__________,证明SO2有__________性。
⑸④的作用__________,反应的化学方程式为______________________________。
![]() 五、计算题
五、计算题
27、使一定质量的锌与100 mL18.5 mol/L浓硫酸充分反应,锌完全溶解,同时生成标准状况下的气体A33.6L。将反应后的溶液稀释至1L,测得溶液c(H+)=0.1mol/L。求气体A中各组分的体积比。