高一化学第二学期期中考试5
第Ⅰ卷
一、选择题(本题共有20小题,第1题至第10题每题2分,第11题至第20题每题3分,共50分。每题只有一个选项符合题意)
1.下列元素中,最高正化合价数值最大的是 ( )
A.C B.S C.F D.Ne
2.R元素气态氢化物的化学式为RH3,则R元素最高价氧化物的化学式是( )
A.R2O5 B.RO2 C.RO3 D.R2O7
3.下列化学电池不会造成环境污染的是( )
A.锂电池 B.锌锰电池 C.镍镉电池 D.氢氧燃料电池
4.与化学反应的速率无关的是( )
A.浓度 B.温度 C.密度 D.催化剂
5.下列属于同位素的一组是( )
A. H2O和D2O B. Na2O和Na2O2 C. 氕、氘、氚 D. 40K、40Ca
6.据报道,某些建筑材料会产生放射性同位素氡222 86Rn,从而对人体产生伤害。该同位素原子的中子数和质子数之差是( )
A.136 B.50 C.86 D.222
7.R元素的原子有三个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是( )
A.R元素处于第三周期VIA族 B.R元素是非金属元素
C.原子核外共有14个电子 D.R元素最低化合价为-2价
8.下列关于化学键的说法正确的是( )
A.化学键是分子和分子之间的作用力
B.形成物质中的化学键时要吸收能量
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.形成和断裂同一种化学键时,放出和吸收的能量是不相等的,这是化学反应中能量变化的主要原因
9.对化学反应限度的叙述,错误的是( )
A.任何可逆反应都有一定的限度 B.化学反应达到限度时,正、逆反应的速率相等
C.化学反应的限度与时间的长短无关 D.化学反应的限度是不可改变的
10.下列各组含氧酸中,酸性依次增强的是( )
A.H2CO3、H2SiO3、H3PO4 B.HNO3、H3PO4、H2SO4
C.H3PO4、H2SO4、HClO4 D. HClO4、H2SO4、H2CO3
11.下列物质中既含有离子键又含有非极性共价键的是( )
A.H2O B.Na2O2 C.CaCl2 D.NaCl
12.已知空气—锌电池的电极反应为:锌片上 Zn+2OH--2e-=ZnO+H2O
石墨棒 O2+2H2O+4e-=4OH- 。据此判断锌片是( )
A.负极、被氧化 B.负极、被还原 C.正极、被氧化 D.正极、被还原
13.下列说法正确的是( )
A.共价化合物中可能含有离子键 B.非金属原子间不可能形成离子化合物
![]() C.不存在没有化学键的分子
D.双原子单质分子中的共价键一定是非极性键
C.不存在没有化学键的分子
D.双原子单质分子中的共价键一定是非极性键
14.X、Y是元素周期表中第VIIA族的两种元素,下列叙述能说明X的非金属比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.Y的单质能将X从NaX的溶液中置换出来
D.X的气态氢化物比Y的气态氢化物稳定
15.N的质量数为14,在粒子NH3T+中,电子数、质子数、中子数之比为( )
A.10:7:11 B.10:11:8 C.10:11:9 D.11:9:10
16.砷为第四周期第VA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是( )
A.砷在通常状况下为固体
B.砷常见的化合价有-3、+3、+5
C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强
D.砷化氢(AsH3)不如氨气(NH3)稳定
17.一定量的浓硝酸与过量的铜充分反应,生成的气体是
A 只有NO2 B 只有NO C NO2和NO D NO2和H2
18.氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1KJ, 破坏1mol氯气中的化学键消耗的能量为Q2KJ,形成1mol氯化氢中的化学键释放的能量为Q3KJ。下列关系式中正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2<Q3 D.Q1+Q2<2Q3
19.天然气(CH4)、液化石油气(C3H8)燃烧的化学方程式分别为
CH4+2O2 CO2+2H2O,C3H8+5O2 3CO2+4H2O,现有一套以天然气为燃料的灶具,欲改为燃烧石油气,应采取的正确措施是( )
A.减小空气进入量,增大石油气进入量 B.增大空气进入量,减小石油气进入量
C.减小空气进入量,减小石油气进入量 D.增大空气进入量,增大石油气进入量
20.有a、b、c三种金属,将a、b放在稀硫酸中,用导线连接,电流方向由a到b。把a放c到的硫酸盐溶液中,a表面有c析出。这三种金属的活动性顺序为( )
A. b>a>c B. a.>b>c C.c>b>a D.c>a>b
高一化学![]()
 第二学期期中考试答题卷
第二学期期中考试答题卷
第Ⅰ卷
一、选择题(本题共有20小题,第1题至第10题每题2分,第11题至第20题每题3分,共50分。每题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(共50分)
二.填空题(共2小题,22分)
21.(14分)下面是元素周期表的一部分:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | I | K | |||
| 3 | B | C | D | G | J |
根据A~K元素在周期表中的位置填空:
(1)单质中氧化性最强的是_______,还原性最强的是______,化学性质最不活泼的是_____(填化学式);
(2)最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是______,表现两性的是_______(填化学式)。写出后一种与前两种化合物分别反应的离子方程式____________________ __、____________________________;
(3)用电子式表示下列粒子或化合物的结构:
①A和H形成的二核阴离子______, ②A和F形成的多核阳离子______,
③化合物EH2________, ④化合物B2H2___________;
(4)用电子式表示下列化合物的形成过程:
①FA3_____________________________,②CJ2__________________________________;
![]()
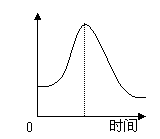 22.(4分)把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如
22.(4分)把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如
右图所示。试回答:
(1)反应开始后速率逐渐变快的原因为____________________
________________________________________;
(2)随后又逐渐变慢的原因为____________________________
________________________________________.
 三.推断题(1小题,8分)
三.推断题(1小题,8分)
23.有A、B、C、D四种前20号元素,A的最高价与其负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,B有两个电子层,其最高正价与最低负价的代数和为零,C2-与氩原子具有相同的电子层结构。
(1)试写出A、D两元素的符号及B、C两元素在周期表中的位置:
A ,D ; B ,C 。
(2)画出下列粒子的结构示意图:
A ,C2- 。
(3)写出A、D的最高价氧化物对应水化物反应的化学方程式
四.实验题(共2小题,18分)
24.(8分)有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们,并贴上标签。
| 操 作 步 骤 | 现 象 及 结 论 | |
| 方法一 | ||
| 方法二 |
25.学习完元素周期律和元素周期表以后,某同学欲用用实验验证元素的金属性与其在元素周期表中位置的关系,设计了如下实验,请填写表中空白:
(1)(4分)Na、Mg与水的反应
| 实验步骤 | 简述实验现象 | 从结构上对现象进行解释 | 结论 |
| 将一粒黄豆大小的金属钠投入到滴加了酚酞的水中 | |||
| 将去掉氧化膜后的镁带,投入到盛有水的试管中,再加两滴酚酞,并加热 |
(2)(4分)Na、K与水的反应
| 实验步骤 | 简述实验现象 | 从结构上对现象进行解释 | 结论 |
| 将一粒黄豆大小的金属钠投入到滴加了酚酞的水中 | |||
| 将一粒绿豆大小的金属钾投入到滴加了酚酞的水中 |
![]() (3)(2分)综合上述实验,某同学得出的结论是___________________________________
(3)(2分)综合上述实验,某同学得出的结论是___________________________________
五.计算题(1小题,6分)
26.在一密闭的2L容器里装有4molSO2和2molO2,在一定条件下开始反应。2min末测得容器中有1.6molSO2,请计算:
(1)2min末SO3的浓度;
(2)2min内SO2的平均反应速率。
![]()
高一化学![]()
 第二学期期中考试参考答案
第二学期期中考试参考答案
第Ⅰ卷
一、选择题(本题共有20小题,第1题至第10题每题2分,第11题至第20题每题3分,共50分。每题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | A | D | C | C | B | C | C | D | C | B | A | D | D | C | C | C | D | B | A |
第Ⅱ卷(共50分)
二.填空题(共2小题,22分)
21.(14分)下面是元素周期表的一部分:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | I | K | |||
| 3 | B | C | D | G | J |
根据A~K元素在周期表中的位置填空:
(1)单质中氧化性最强的是__F2_____,还原性最强的是__Na____,化学性质最不活泼的是__Ne___(填化学式);
(2)最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH ,表现两性的是Al(OH)3(填化学式)。写出后一种与前两种化合物分别反应的离子方程式____________________ __、____________________________;
(3)用电子式表示下列粒子或化合物的结构:
①A和H形成的二核阴离子______, ②A和F形成的多核阳离子______,
③化合物EH2________, ④化合物B2H2___________;
(4)用电子式表示下列化合物的形成过程:
①FA3_____________________________,②CJ2__________________________________;
![]()
 22.(4分)把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如
22.(4分)把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如
右图所示。试回答:
(1)反应开始后速率逐渐变快的原因为__________________
________________________________________;
(2)随后又逐渐变慢的原因为__________________________
________________________________________.
 三.推断题(1小题,8分)
三.推断题(1小题,8分)
24.有A、B、C、D四种前20号元素,A的最高价与其负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,B有两个电子层,其最高正价与最低负价的代数和为零,C2-与氩原子具有相同的电子层结构。
(1)试写出A、D两元素的符号及B、C两元素在周期表中的位置:
A ,D ; B ,C 。
(2)画出下列粒子的结构示意图:
A ,C2- 。
(3)写出A、D的最高价氧化物对应水化物反应的化学方程式
四.实验题(共2小题,18分)
23.(8分)(合理的答案均可,但都必须有操作、现象、结论的叙述)
| 操 作 步 骤 | 现 象 及 结 论 | |
| 方法一 | (1)各取少量溶液于试管中,分别滴加BaCl2溶液 (2)各取剩余的两种溶液于试管中,分别滴加AgNO3溶液 | 产生白色沉淀的是稀硫酸 产生白色沉淀的是稀盐酸,剩余的是稀硝酸 |
| 方法二 | (1)各取少量溶液于试管中,分别加入铜片 (2)各取剩余的两种溶液于试管中,分别滴加BaCl2溶液 | 有气泡产生的是稀硝酸 产生白色沉淀的是稀硫酸,剩余的是稀盐酸 |
24.(1)(4分)Na、Mg与水的反应
| 实验步骤 | 简述实验现象 | 从结构上对现象进行解释 | 结论 |
| 将一粒黄豆大小的金属钠投入到滴加了酚酞的水中 | |||
| 将去掉氧化膜后的镁带,投入到盛有水的试管中,再加两滴酚酞,并加热 |
(2)(4分)Na、K与水的反应
| 实验步骤 | 简述实验现象 | 从结构上对现象进行解释 | 结论 |
| 将一粒黄豆大小的金属钠投入到滴加了酚酞的水中 | |||
| 将一粒绿豆大小的金属钾投入到滴加了酚酞的水中 |
(3)(2分)综合上述实验,某同学得出的结论是___________________________________
五.计算题(1小题,6分)
25.在一密闭的2L容器里装有4molSO2和2molO2,在一定条件下开始反应。2min末测得容器中有1.6molSO2,请计算:
(1)2min末SO3的浓度;
(2)2min内SO2的平均反应速率。
